
【题目】[化学-—选修3:物质结构与性质]东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为_________,3d能级上的未成对的电子数为______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是_____。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是_____。
③氨的沸点 (填“高于”或“低于”)膦(PH3),原因是______;氨是_____分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)单质铜及镍都是由______键形成的晶体:元素铜与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是______。
(4)某镍白铜合金的立方晶胞结构如图所示。

①晶胞中铜原子与镍原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm
【答案】(1)1s22s22p63s23p63d84s2或[Ar] 3d84s2 2
(2)①正四面体
②配位键 N
③高于 NH3分子间可形成氢键 极性 sp3
(3)金属 铜失去的是全充满的3d10电子,镍失去的是4s1电子
(4)①3:1
②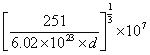
【解析】
试题分析:(1)镍是28号元素,位于第四周期,第Ⅷ族,根据核外电子排布规则,其基态原子的电子排布式为1s22s2 2p63s23p63d84s2,3d能级有5个轨道,这5个轨道先占满5个自旋方向相同的电子,再分别占据三个轨道,电子自旋方向相反,所以未成对的电子数为2。
(2)①根据价层电子对互斥理论,SO42-的σ键电子对数等于4,孤电子对数(6+2-2×4)÷2=0,则阴离子的立体构型是正四面体形。
②根据配位键的特点,在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为配位键,提供孤电子对的成键原子是N。
③氨气分子间存在氢键,分子间作用力强,所以氨的沸点高于膦(PH3);根据价层电子对互斥理论,氨气中心原子N的σ键电子对数等于3,孤电子对数(5-3)÷2=1,则中心原子N是sp3杂化,分子成三角锥形,正负电荷重心不重叠,氨气是极性分子。
(3)铜和镍属于金属,所以单质铜及镍都是由金属键形成的晶体;铜和镍分别失去一个电子后若再失去电子,铜失去的是全充满的3d10电子,镍失去的是4s1电子,所以ICu>INi。
(4)①根据均摊法计算,晶胞中铜原子个数为6×1/2=3,镍原子的个数为8×1/8=1,则铜和镍的数量比为3:1。
②根据上述分析,该晶胞的组成为Cu3Ni,合金的密度为dg/cm3,根据p=m÷V=251÷[(a3×NA)]=d,1cm=107nm,则晶胞参数a=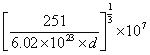 nm。
nm。


科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下,S2Cl2遇水易与水发生反应,并产生能使品红褪色的气体。下列说法错误的是( )

A.S2Cl2的结构中各原子均达到8电子的稳定结构
B.S2Cl2为含有极性键和非极性键的共价化合物
C.若S2Br2与S2Cl2结构相似,则熔沸点:S2Cl2>S2Br2
D.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某盐R的化学工为XmYnZp(X、Y、Z为三种不同离子),其组成元素均为短周期元素,取两份等质量等浓度R的水溶液各5 mL进行如下实验:
Ⅰ.取一份R的水溶液与过量的Ba(OH)2溶液反应,反应过程中生成白色沉淀,沉淀量先增加后减少,最终剩余沉淀甲4.66g,且甲不溶于稀盐酸。
Ⅱ.取另一份R的水溶液与过量的NaOH溶液混合加热,生成具有刺激性气味的气体乙0.224L(标准状况),乙能使湿润的红色石蕊试纸变蓝。
据此回答:
(1)写出R和甲的化学式:R ;甲 。
(2)另取500mL R的水溶液,向其中逐滴加入NaOH溶液,所得沉淀与加入的NaOH的物质的量关系如图所示。则:
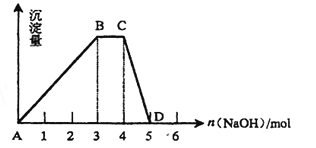
①R溶液的物质的量浓度为 。
②BC段表示的含义是 。
③CD段表示的含义是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1mol·L-1的NaOH溶液滴定25mL0.1mol·L-1的H2C2O4(草酸)溶液的滴定曲线如图所示。下列说法不正确的是( )

A. 草酸是弱酸
B. X点:c(H2C2O4)+c(HC2O4-)=c(Na+)-c(C2O42-)
C. Y点:c(H2C2O4)+c(HC2O4-)=c(OH-)-c(H+)
D. 滴定过程中始终存在:c(OH-)+2c(C2O42-)+ c(HC2O4-)= c(Na+)+ c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知;还原性HSO3->I-,氧化性IO3->I2。在含3 mol NaHSO3的溶液中逐滴加入NaIO3溶液。加入NaIO3的物质的量和和析出的I2的物质的量的关系曲线如图。下列说法正确的是()

A.反应过程中的氧化产物均为Na2SO4
B.a 点时消耗NaHSO3的物质的量为1.0mol
C.0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-+3OH-=3SO42-+I-+3H2O
D.当溶液中I-与I2的物质的量之比为5:3时,加入的NaIO3为1.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中,不正确的是
A.“光化学烟雾”“硝酸型酸雨”的形成都与氮氧化合物有关
B.根据分散质微粒直径大小可以将分散系分为溶液、胶体和浊液
C.SiO2可用于制造光导纤维,其性质稳定,不溶于强酸、强碱
D.焰火的五彩缤纷是某些金属元素的性质的表现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,6— 己二酸(G)是合成尼龙的重要原料之一,可用六个碳原子的化合物氧化制备。下图为A通过氧化反应制备G的反应过程(可能的反应中间物质为B、C、D、E和F)。

回答下列问题:
(1)化合物A中含碳87.8%,其余为氢,A的化学名称为________________。
(2)B到C的反应类型为________________。
(3)F的结构简式为________________。
(4)在上述中间物质中,核磁共振氢谱出峰最大的是_________,最少的是__________(填化合物代号)。
(5)由G合成尼龙的化学方程式为_________________________。
(6)由A通过两步制备1,3—环己二烯的合成线路为_____________________。
(7) 有机物C的同分异构体属于酯类的有 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. N2、NO、NO2都是大气污染气体,在空气中都能稳定存在
B. 向AlCl3溶液中滴加过量的氨水能看到先产生白色沉淀,后沉淀溶解
C. 在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉就会溶解
D. 可用浓硫酸或者浓硝酸除去镀在铝表面的铜镀层
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com