
| A. | 通入过量SO2气体后仍能大量共存H+、Fe2+、I?、SO42? | |
| B. | 使石蕊变红的溶液中可能大量存在Na+、Mg2+、NO3?、C17H35COO? | |
| C. | 强碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- | |
| D. | 加入Al 可以放出H2的溶液中可能大量存在Fe3+、K+、Cl?、NO3- |
分析 A.四种离子之间不反应,通入二氧化硫气体后也不反应;
B.使石蕊变红的溶液中存在大量氢离子,C17H35COO?与氢离子反应;
C.碳酸氢根离子与强碱性溶液中的氢氧根离子反应;
D.该溶液呈强碱性或酸性,铁离子与氢氧根离子反应,硝酸根离子在酸性条件下与铝反应不会生成氢气.
解答 解:A.H+、Fe2+、I?、SO42?之间不反应,通入二氧化硫后也不反应,在溶液中能够大量共存,故A正确;
B.该溶液为酸性溶液,C17H35COO?与酸性溶液中的氢离子反应,在溶液中不能大量共存,故B错误;
C.HCO3-与强碱性溶液中的氢氧根离子反应,在溶液中不能大量共存,故C错误;
D.加入铝放出氢气的溶液中存在大量氢离子或氢氧根离子,Fe3+与氢氧根离子反应,NO3-在酸性溶液中具有强氧化性,与铝反应不会生成氢气,故D错误;
故选A.
点评 本题考查离子共存的判断,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | (CH3)2CHCH2Cl | B. | CH3C(CH3)2I | C. | (CH3)3COOCH2CH3 | D. | CH3C(CH3)2CH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiC俗称金刚砂,可用作砂纸、砂轮的磨料 | |
| B. | 金属铝熔点高,所以我们可以用铝制器皿煮饭 | |
| C. | 硅酸钠俗称水玻璃,可用作黏合剂和木材防火剂 | |
| D. | 二氧化硫有毒,严禁将其添加到任何食品和饮料中 |
查看答案和解析>>
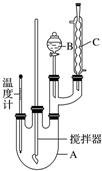
科目:高中化学 来源: 题型:实验题
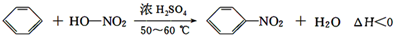
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | 83 | 1.4 | 易溶于水 | |
| 浓硫酸 | 338 | 1.84 | 易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
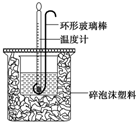 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和右图所示装置进行测定中和热的实验,得到表中的数据
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和右图所示装置进行测定中和热的实验,得到表中的数据| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃[来源:Z,xx,k.Com] | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.3 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 20.5 | 20.6 | 24.9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com