��������һ�������Դ��
��1����֪ 2H
2��g��+O
2��g��=2H
2O��g����H=-483.6kJ/mol��2H
2��g��+O
2��g��=2H
2O��l����H=-571.6kJ/mol
�ٱ�ʾ����ȼ���ȵ��Ȼ�ѧ����ʽ��
H
2+
O
2=H
2O��l����H=-285.8kJ/mol
H
2+
O
2=H
2O��l����H=-285.8kJ/mol
��ȼ��2g H
2����ˮ�������ų�������Ϊ
241.8
241.8
kJ��
��2�����ǿ���ͨ������;����ȡ������14g CO������ˮ������Ӧ����CO
2��H
2����ų�20.5kJ�������˷�Ӧ���Ȼ�ѧ����ʽΪ
CO��g��+H2O��g��=CO2��g��+H2��g����H=-41kJ/mol
CO��g��+H2O��g��=CO2��g��+H2��g����H=-41kJ/mol
��
��ú�ǻ�ʯȼ�ϣ�úȼ�յķ�Ӧ�ȿ�ͨ����������;�������ã�a������ú�ڳ���Ŀ�����ֱ��ȼ�ղ����ķ�Ӧ�ȣ�b����ʹú��ˮ������Ӧ�õ�������һ����̼��Ȼ����ʹ�õ���������һ����̼�ڳ���Ŀ�����ȼ�գ����������̵Ļ�ѧ����ʽΪ��
a��C��s��+O
2��g��=CO
2��g����H=E
1 ��
b��C��s��+H
2O��g��=CO��g��+H
2��g����H=E
2 ��
H
2��g��+
O
2��g��=H
2O��g����H=E
3 ��
CO��g��+
O
2��g��=CO
2��g����H=E
4 ��
��ش𣺣�1�������ĸ��Ȼ�ѧ����ʽ���ĸ���Ӧ��H��0��
��
��
������ţ�
��2����������ú�ֱ�ͨ������������ͬ��;�������Ŀ����õ���������ϵ��ȷ����
C
C
��
A��a��b�� B�� a��b�� C��a��b����������ͬ
����֪��N
2��g��+3H
2��g���T2NH
3��g����H=-92.4kJ/mol
H
2��g��+Cl
2��g���T2HCl��g����H=-184.6kJ/mol
N
2��g��+2H
2��g��+
Cl
2��g���TNH
4Cl��s����H=-313.6kJ/mol
����NH
3��g��+HCl��g���TNH
4Cl��s���ķ�Ӧ�ʱ䣺��H=
-175.1kJ/mol
-175.1kJ/mol
��


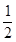 O2(g) �� H2O��g�� ��H=E3 ��
O2(g) �� H2O��g�� ��H=E3 ��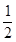 O2(g) �� CO2(g) ��H=E4 ��
O2(g) �� CO2(g) ��H=E4 ��