
 Pb(s) + CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表
Pb(s) + CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表| 温度 | 300 | 727 | 1227 |
| lgK | 6.17 | 2.87 | 1.24 |
 Pb(OH)3- ②Pb2+
Pb(OH)3- ②Pb2+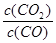 =
=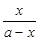 =10,解得
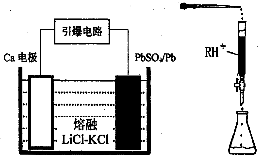
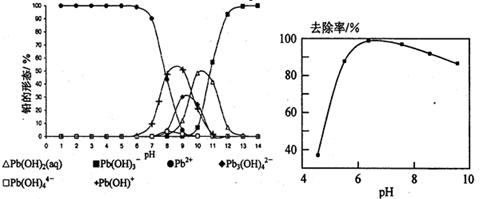
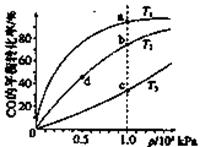
=10,解得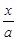 =9.09%。(3)由电池的装置图分析知,Ca作为负极,失去电子。则另一极为正极,得电子,化合价降低,即由PbSO4转化为Pb。(4)滴定过程中消耗的OH-,即为阳离子交换出来的H+,n(H+)=0.0025×20×10-3,c(H+)=n(H+)/25×10-3=2×10-3 mol/L,而C(H+)=C(I-),由PbI2的化学式知,C(Pb2+)= C(I-)/2=10-3 mol/L,Ksp(PbI2)=c(Pb2+)c2(I-)= 10-3×(2×10-3)2=4×10-9。(5)从左图分析,当pH由11变到13时,是Pb(OH)2向Pb(OH)3-转化,结合一个OH-。从右图看,铅的去除率最高时,pH大约为6.5左右,对比左图知,在pH=6.5时,铅主要以Pb2+存在。
=9.09%。(3)由电池的装置图分析知,Ca作为负极,失去电子。则另一极为正极,得电子,化合价降低,即由PbSO4转化为Pb。(4)滴定过程中消耗的OH-,即为阳离子交换出来的H+,n(H+)=0.0025×20×10-3,c(H+)=n(H+)/25×10-3=2×10-3 mol/L,而C(H+)=C(I-),由PbI2的化学式知,C(Pb2+)= C(I-)/2=10-3 mol/L,Ksp(PbI2)=c(Pb2+)c2(I-)= 10-3×(2×10-3)2=4×10-9。(5)从左图分析,当pH由11变到13时,是Pb(OH)2向Pb(OH)3-转化,结合一个OH-。从右图看,铅的去除率最高时,pH大约为6.5左右,对比左图知,在pH=6.5时,铅主要以Pb2+存在。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源:不详 题型:单选题
 2C(g),下列各数据表示同一反应速率是
2C(g),下列各数据表示同一反应速率是 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 测定时刻/s | t1 | t2 | t3 | t4 |
| c(A)/(mol/L) | 6 | 3 | 2 | 2 |
| c(B)/(mol/L) | 5 | 3.5 | 3 | 3 |
| c(C)/(mol/L) | 1 | 2.5 | 3 | 3 |
 2C
2C查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CH3OH(g)的平衡常数如下表。按照相同的物质的量投料,
CH3OH(g)的平衡常数如下表。按照相同的物质的量投料,| 平衡常数 | 温度/℃ | ||
| 500 | 700 | 800 | |
| K | 2.50 | 0.34 | 0.15 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Z 在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述不正确的是 ( )
Z 在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述不正确的是 ( ) 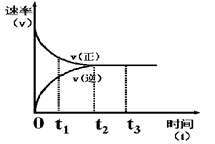
| A.t1时,正反应速率大于逆反应速率 |
| B.t2时,达到该条件下的最大反应限度 |
| C.t2- t3,反应不再发生,各物质的浓度相等 |
| D.t3后,该反应的反应限度有可能被外界条件改变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 x Q(g)+3R(g),经2min达平衡,生成2.4molR,并测得Q的浓度为0.4mol/L。求:
x Q(g)+3R(g),经2min达平衡,生成2.4molR,并测得Q的浓度为0.4mol/L。求:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.降低生产能耗 | B.使反应物的化学键不需破坏 |
| C.使反应更完全 | D.使反应放出更多的热量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:| 温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
 A(g)+B(g)的平衡常数的值为0.4
A(g)+B(g)的平衡常数的值为0.4查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com