
| A、元素周期律是元素原子核外电子排布周期性变化的结果 |
| B、HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱 |
| C、第三周期非金属元素含氧酸的酸性从左到右依次增强 |
| D、形成离子键的阴阳离子间只存在静电吸引力 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在镀件上电镀铜,用铜作阳极 |
| B、电解法精炼粗铜,用粗铜作阴极 |
| C、氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- |
| D、用电解饱和食盐水的方法制取金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某反应的反应过程中能量变化如图所示,(图中E1表示反应的活化能,E2表示活化分子变成生成物分子放出的能量).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示,(图中E1表示反应的活化能,E2表示活化分子变成生成物分子放出的能量).下列有关叙述正确的是( )| A、该反应为放热反应 |
| B、该反应为吸热反应 |
| C、催化剂能改变反应的焓变 |
| D、催化剂能降低反应的活化能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、硫离子的结构示意图: | ||
B、NH4Cl的电子式: | ||
C、原子核内有10个中子的氧原子:
| ||
D、Na2O2的电子式为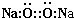 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钙受热分解,其生成物总能量高于反应物总能量 |
| B、断开化学键的过程会放出能量 |
| C、加热才能发生的反应一定是吸热反应 |
| D、氧化反应均为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com