
| A���٢ۢݡ��� �� | B���ڢܢޡ������� | C���٢ڢۡ������� | D���ܢݢ� |
 Ӯ�ڿ�����ʦ��ʱ�ƻ�ϵ�д�
Ӯ�ڿ�����ʦ��ʱ�ƻ�ϵ�д� �������Ͽ�ʱͬ��ѵ��ϵ�д�
�������Ͽ�ʱͬ��ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ʯī�Ƚ��ʯ���ȶ� | B�����ʯ��ʯī���ȶ� |
| C��ʯīת���ɽ��ʯ�������仯 | D��ʯī�ͽ��ʯ�Ľṹ��ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��CH3OH��ȼ����Ϊ192.9 kJ��mol-1 |
| B����Ӧ���еķ�Ӧ������������������������� |
| C��CH3OHת���H2�Ĺ���һ��Ҫ�������� |
| D�����ݢ���֪��Ӧ��CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g) ��DH����192.9 kJ��mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2SO3��g������Ӧ���̵������仯����ͼ��ʾ����֪1mol SO2��g������Ϊ1 mol SO3��g���ġ�H="�C99" kJ��mol����ش��������⣺
2SO3��g������Ӧ���̵������仯����ͼ��ʾ����֪1mol SO2��g������Ϊ1 mol SO3��g���ġ�H="�C99" kJ��mol����ش��������⣺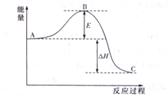
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������ת��Ϊ�����������仯 |
| B������ͬ�����º��ױȰ����ȶ� |
| C����ͬ������,���������е��������Ȱ��ĸ� |
| D����ͬ�����ĺ��Ͱ�����ȫȼ�շų���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 ? 2SO3(g)����Ӧ���̵������仯��ͼ��ʾ����֪1 mol SO2(g)����Ϊ1 mol SO3(g)�Ħ�H����99 kJ/mol��
? 2SO3(g)����Ӧ���̵������仯��ͼ��ʾ����֪1 mol SO2(g)����Ϊ1 mol SO3(g)�Ħ�H����99 kJ/mol��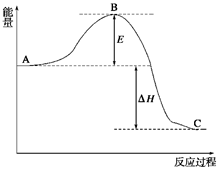
 v(O2)�� mol/(L��min)��v(SO3)�� mol/(L��min)��
v(O2)�� mol/(L��min)��v(SO3)�� mol/(L��min)�� ?SO2(g) ��H����296 kJ/mol��������S(s)����3 mol SO3(g)�Ħ�H ��
?SO2(g) ��H����296 kJ/mol��������S(s)����3 mol SO3(g)�Ħ�H ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
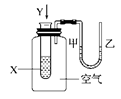
| A���٢ڢ� | B���٢� | C���٢� | D���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
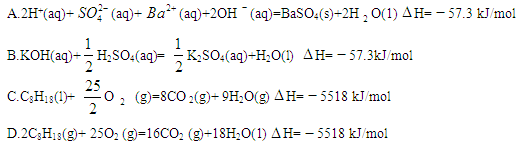
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com