
 ? 2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
? 2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。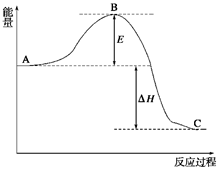
 v(O2)= mol/(L·min)、v(SO3)= mol/(L·min);
v(O2)= mol/(L·min)、v(SO3)= mol/(L·min); ?SO2(g) ΔH=-296 kJ/mol,计算由S(s)生成3 mol SO3(g)的ΔH 。
?SO2(g) ΔH=-296 kJ/mol,计算由S(s)生成3 mol SO3(g)的ΔH 。 2SO3(g) ΔH=-198 kJ/mol和②S (s)+O2(g)
2SO3(g) ΔH=-198 kJ/mol和②S (s)+O2(g) SO2(g) ΔH=-296 kJ/mol联立即①+②×2得2S(s)+3O2(g)
SO2(g) ΔH=-296 kJ/mol联立即①+②×2得2S(s)+3O2(g) 2SO3(g) ΔH=-790 kJ/mol,所以由S(s)生成3 mol SO3(g)的ΔH=
2SO3(g) ΔH=-790 kJ/mol,所以由S(s)生成3 mol SO3(g)的ΔH=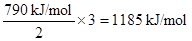 。
。

 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源:不详 题型:单选题
| A.放热反应,不必加热就一定能发生 |
| B.化学反应中一定有能量变化 |
| C.吸热反应不一定需要加热也能发生 |
| D.热化学方程式中,热效应数值与反应物的物质的量多少有关 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.由C(石墨,s)→C(金刚石,s);ΔH=" +2.1kJ/mol" 可知,石墨比金刚石稳定 |
| B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
| C.在101Kpa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);ΔH= +285.8kJ/mol |
| D.稀溶液中:H+(aq)+OH—(aq)=H2O(l);ΔH=" -57.3kJ/mol" ,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量大于57.3kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
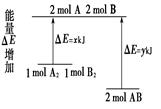
| A.该反应是吸热反应 |
| B.断裂1 mol A—A 键和1 mol B—B 键放出x kJ能量 |
| C.断裂2 mol A—B 键需要吸收y kJ的能量 |
| D.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③⑤ | B.②④⑥ | C.①②③ | D.④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
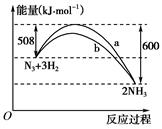
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.红磷比白磷稳定 | B.白磷转化成红磷吸收热量 |
| C.红磷转化成白磷为放热反应 | D.等量的白磷和红磷相互转化时的能量变化值不相等 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
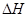 的绝对值均正确)( )
的绝对值均正确)( )| A.C2H5OH(l)+3O2(g)==2CO2(g) +3H2O(g);△H=" —1367.0" kJ/mol(燃烧热) |
| B.NaOH(aq) + HCl(aq) ="=" NaCl(aq) + H2O(l);△H= —57.3kJ(中和热) |
| C.S(s) + O2(g) ="=" SO2(g);△H= —269.8kJ/mol(反应热) |
| D.2NO2==O2+2NO;△H= +116.2kJ/mol(反应热) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SiCl4+H2 ="=" SiHCl3+HClΔH=" +31" kJ/mol |
| B.SiCl4+H2 ="=" SiHCl3+2HCl ΔH=" -31" kJ/mol |
| C.SiCl4(g)+H2(g) ="=" SiHCl3(g)+HCl(g) ΔH="+31" kJ/mol |
| D.SiCl4(g)+H2(g) ="=" SiHCl3(g)+2HCl(g) ΔH=" -31" kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com