
【题目】某合成有机光电材料的中间体,结构简式如图所示。下列说法正确的是
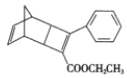
A.属于芳香烃B.分子式为C18H16O2
C.苯环上的二氯取代物有6种D.性质稳定,不与强酸、强碱、强氧化剂反应
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】钛矿工业中的硫酸酸性废水富含Ti、Fe等元素,其综合利用如下:

已知:TiO2+易水解,只能存在于强酸性溶液中。
(1)TiO2+钛的化合价为________________________。
(2)步骤Ⅰ中检验钛矿废水中加入铁屑是否足量的试剂是________________________。
(3)操作a是蒸发浓缩、冷却结晶、______________________________________________。
(4)步骤Ⅲ中发生反应的化学方程式为________________________;反应温度一般需控制在35℃以下,其目的是____________________________________。
(5)已知Ksp=[Fe(OH)2] = 8×10-16。步骤Ⅲ中,FeCO3达到溶解平衡时,若室温下测得溶液的pH为8.5, c(Fe2+) = 1×10-6mol/L。试判断所得的FeCO3中________(填“有”或“没有”)Fe(OH)2;步骤Ⅳ中,为了得到较为纯净的Fe2O3,除了适当的温度外,还需要采取的措施是_________________。
(6)向“富含TiO2+溶液”中加入Na2CO3粉末易得到固体TiO2 nH2O。请结合原理和化学用语解释其原因_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符合的是( )
A.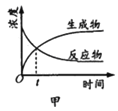 图甲表示某可逆反应中物质浓度随时间的变化,反应在t时刻达到平衡状态
图甲表示某可逆反应中物质浓度随时间的变化,反应在t时刻达到平衡状态
B.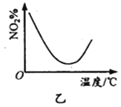 图乙表示NO2在恒容密闭容器中发生反应:2NO2(g)
图乙表示NO2在恒容密闭容器中发生反应:2NO2(g) ![]() N2O4(g),NO2体积分数与温度的变化曲线,则该反应的正反应△H<0
N2O4(g),NO2体积分数与温度的变化曲线,则该反应的正反应△H<0
C.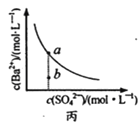 图丙表示某温度时,BaSO4在水中的溶解平衡曲线,蒸发水可使溶液由b点变到a点
图丙表示某温度时,BaSO4在水中的溶解平衡曲线,蒸发水可使溶液由b点变到a点
D.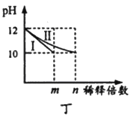 图丁表示分别稀释10 mL pH均为12的NaOH和NH3H2O溶液时pH的变化,曲线I表示NH3H2O溶液,n>100
图丁表示分别稀释10 mL pH均为12的NaOH和NH3H2O溶液时pH的变化,曲线I表示NH3H2O溶液,n>100
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验所得结论正确的是
① | ② | ③ | ④ |
|
|
|
|
充分振荡试管,下层溶液红色褪去 | 溶液变红 | 溶液变红 | 充分振荡右侧小试管, 下层溶液红色褪去 |
A.①中溶液红色褪去的原因是:CH3COOC2H5+NaOH![]() CH3COONa+C2H5OH
CH3COONa+C2H5OH
B.②中溶液变红的原因是:CH3COO-+H2O![]() CH3COOH+H+
CH3COOH+H+
C.由实验①、②、③推测,①中红色褪去的原因是乙酸乙酯萃取了酚酞
D.④中红色褪去证明右侧小试管中收集到的乙酸乙酯中混有乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于某有机物![]() 的性质叙述正确的是( )
的性质叙述正确的是( )
A. 1 mol该有机物可以与3 mol Na发生反应
B. 1 mol该有机物可以与3 mol NaOH发生反应
C. 1 mol该有机物可以与6 mol H2发生加成反应
D. 1 mol该有机物分别与足量Na或NaHCO3反应,产生的气体在相同条件下体积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】快离子导体是一类具有优良离子导电能力的固体电解质。图1(Li3SBF4)和图2是潜在的快离子导体材料的结构示意图。回答下列问题:

(1)BF3+NH3=NH3·BF3的反应过程中,形成配位键时提供电子的原子是__,其提供的电子所在的轨道是__。
(2)基态Li+、B+分别失去一个电子时,需吸收更多能量的是__,理由是__。
(3)图1所示的晶体中,锂原子处于立方体的位置__。若其晶胞参数为apm,则晶胞密度为___g·cm-3(列出计算式即可)。
(4)氯化钠晶体中,Cl-按照A1密堆方式形成空隙,Na+填充在上述空隙中,则每一个空隙由__个Cl-构成,空隙的空间形状为___。
(5)当图2中方格内填入Na+时,恰好构成氯化钠晶胞的![]() ,且氯化钠晶胞参数a=564pm。温度升高时,NaCl晶体出现缺陷(如图2所示,某一个顶点没有Na+,出现空位),晶体的导电性大大增强。该晶体导电时,在电场作用下迁移到空位上,形成电流。迁移的途径有两条(如图2中箭头所示):
,且氯化钠晶胞参数a=564pm。温度升高时,NaCl晶体出现缺陷(如图2所示,某一个顶点没有Na+,出现空位),晶体的导电性大大增强。该晶体导电时,在电场作用下迁移到空位上,形成电流。迁移的途径有两条(如图2中箭头所示):
途径1:在平面内挤过2、3号氯离子之间的狭缝(距离为x,如图3)迁移到空位。
途径2:挤过由1、2、3号氯离子形成的三角形通道(如图3,小圆的半径为y)迁移到空位。已知:r(Cl-)=185pm,![]() =1.4,
=1.4,![]() =1.7。
=1.7。
①x=__,y=__;(保留一位小数)
②迁移可能性更大的途径是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)![]() 2CO2(g)+S(l)+Q(Q﹥0),若反应在恒容密闭容器中进行,下列有关说法正确的是( )
2CO2(g)+S(l)+Q(Q﹥0),若反应在恒容密闭容器中进行,下列有关说法正确的是( )
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其它条件不变,分离出硫,正反应速率加快
C.达到平衡时,SO2、CO、CO2的平衡浓度一定为1:2:2
D.平衡时,其他条件不变,升高温度SO2的转化率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为Ts(中文名“![]() ”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的电子数
C.Ts在同族元素中非金属性最弱
D.中子数为176的Ts核素符号是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是( )
A. ![]() mol·L-1B.
mol·L-1B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1D.
mol·L-1D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com