
����Ŀ�����仯�����ڹ�ҵ����������;�����������Ҫ�ɷ�ΪMg2B2O5H2O����������Fe2O3��FeO��CaO��Al2O3��SiO2�ȣ�Ϊԭ���Ʊ����ᣨH3BO3���Ĺ���������ͼ��ʾ�� 
��֪��Fe3+��Al3+��Fe2+��Mg2+������������ʽ��ȫ����ʱ����Һ��pH�ֱ�Ϊ3.2��4.9��9.7��12.4��
�ش��������⣺
��1��Ϊ��ߡ����������ʣ����ʵ���������Ũ���⣬���ɲ�ȡ�Ĵ�ʩ����
��2��ʵ�����й��˲�������Ҫ�IJ��������У�����������
��3�����������е�����������ѧʽ����
��4�����������ӡ����ȼ�H2O2��Һ�������� �� Ȼ���ٵ�����Һ��pHԼΪ5��Ŀ������
��5���������ᡱ�е���Ҫ�������������ƣ���
��6���������������������������������ܵ���֣�������ͽ���þΪԭ���ڼ��������¿��Ʊ������� �û�ѧ����ʽ��ʾ�Ʊ�����
���𰸡�
��1����߷�Ӧ�¶Ȼ��С����������
��2���ձ���©��
��3��SiO2��CaSO4
��4����������������Ϊ�����ӣ�ʹ�����ӡ��������γ����������������ȥ
��5����ˮ����þ
��6��2H3BO3 ![]() B2O3+3H2O��B2O3+3Mg
B2O3+3H2O��B2O3+3Mg ![]() 2B+3MgO
2B+3MgO
���������⣺���������Ҫ�ɷ�ΪMg2B2O5H2O��Fe3O4 �� ��������Fe2O3��FeO��CaO��Al2O3��SiO2�ȣ�Ϊԭ���Ʊ����ᣨH3BO3���������̿�֪���������ܽ�ֻ��SiO2���ܣ�CaOת��Ϊ����ˮ��CaSO4 �� ���������ӡ����ȼ�H2O2��Һ������������ת��Ϊ�����ӣ�������Һ��pHԼΪ5��ʹ�����ӡ������Ӿ�ת��Ϊ������������Ϊ��������������������Ȼ������Ũ������ȴ�ᾧ�����˷����H3BO3 �� ��1��Ϊ��߽������ʣ����ʵ���������Ũ��Ũ���⣬���ɲ�ȡ�Ĵ�ʩ����߷�Ӧ�¶Ȼ��С�����������ȣ� ���Դ��ǣ���߷�Ӧ�¶Ȼ��С��������������2��ʵ�����й��˲�������Ҫ�IJ��������У����������ձ���©����
���Դ��ǣ��ձ���©������3���������Ҫ�ɷ�ΪMg2B2O5H2O��Fe3O4 �� ��������Fe2O3��FeO��CaO��Al2O3��SiO2�ȣ���SiO2���������ᣬ�����ܽ�����в���������ܣ����ԡ��������л�ʣ���������SiO2��CaSO4 ��
���Դ��ǣ�SiO2��CaSO4����4�����������ӡ����ȼ�H2O2��Һ�������ǽ�������������Ϊ�����ӣ�Ȼ���ڵ�����Һ��pHԼΪ5��Ŀ����ʹ�����ӡ��������γ����������������ȥ��
���Դ��ǣ���������������Ϊ�����ӣ�ʹ�����ӡ��������γ����������������ȥ����5�����Ũ���ᾧʱ����þ���ˮ�Ծ��������������ᡱ�е���Ҫ��������ˮ����þ��
���Դ��ǣ���ˮ����þ�� ��6��������ͽ���þΪԭ�Ͽ��Ʊ�������Ļ�ѧ����ʽΪ2H3BO3 ![]() B2O3+3H2O��B2O3+3Mg
B2O3+3H2O��B2O3+3Mg ![]() 2B+3MgO��
2B+3MgO��
���Դ��ǣ�2H3BO3 ![]() B2O3+3H2O��B2O3+3Mg
B2O3+3H2O��B2O3+3Mg ![]() 2B+3MgO��
2B+3MgO��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ������ʯ�ͻ�����չˮƽ����
A. ��ϩ����B. �������C. �Ҵ�����D. �������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ��Ӧ�����ֻ������ͷ�Ӧ�Ĺ�ϵ��ͼ��ʾ�������л�ѧ��Ӧ��������3���ǣ�������
A.4Fe��0H��2+O2+2H2O�T4Fe��OH��3
B.2H2O2 ![]() 2H2O+O2��
2H2O+O2��
C.3CO+Fe2O3 ![]() 3CO2+2Fe
3CO2+2Fe
D.Zn+H2SO4�TZnSO4+H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ����ʹ��Ӧ���ʼӿ����
�����ӷ�Ӧ������ʵ����������¶Ȣ���С��Ӧ����������ܼ���������ݼ���MnO2
A. ȫ��B. �٢ڢ�C. ��D. �ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����仯�����ڹ�ҵ����������;�����������Ҫ�ɷ�ΪMg2B2O5H2O����������Fe2O3��FeO��CaO��Al2O3��SiO2�ȣ�Ϊԭ���Ʊ����ᣨH3BO3���Ĺ���������ͼ��ʾ�� 
��֪��Fe3+��Al3+��Fe2+��Mg2+������������ʽ��ȫ����ʱ����Һ��pH�ֱ�Ϊ3.2��4.9��9.7��12.4��
�ش��������⣺
��1��Ϊ��ߡ����������ʣ����ʵ���������Ũ���⣬���ɲ�ȡ�Ĵ�ʩ����
��2��ʵ�����й��˲�������Ҫ�IJ��������У�����������
��3�����������е�����������ѧʽ����
��4�����������ӡ����ȼ�H2O2��Һ�������� �� Ȼ���ٵ�����Һ��pHԼΪ5��Ŀ������
��5���������ᡱ�е���Ҫ�������������ƣ���
��6���������������������������������ܵ���֣�������ͽ���þΪԭ���ڼ��������¿��Ʊ������� �û�ѧ����ʽ��ʾ�Ʊ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ʵ�����������ķ�Ӧ��Zn+2HCl=ZnCl2+H2��������13.0gZn����һ����2mol/Lϡ�����ַ�Ӧ��һ��ʱ���Zn����ʣ�࣮
��1����˫���Ż����ű������ת�Ƶķ������Ŀ
��2���Ƚ�H+��Zn2+������ǿ��
��3��������������������������
��4������ZnCl2�����ʵ���Ϊ���٣�
��5����״���£�������ռ������������壿
��6����Ӧ��ת�Ƶĵ��ӵĸ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����н�������A������ס��ҡ���������B��C��D��E��F��G������֮���ܷ�����ͼ��Ӧ��ͼ����Щ��Ӧ�IJ���ͷ�Ӧ������û��ȫ���������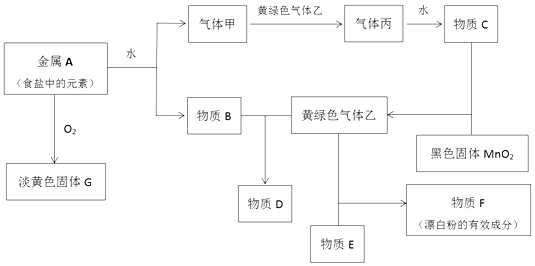
�����������Ϣ�ش��������⣺
��1��ʵ������ȡ�����Ļ�ѧ����ʽΪ4HCl��Ũ��+MnO2 ![]() Cl2��+MnCl2+2H2O��
Cl2��+MnCl2+2H2O��
MnO2 �����������Ӧ�����������ڱ�������Ϊ2.24L����������HCl�����ʵ�����mol
��2��д�����з�Ӧ�����ӷ���ʽ��
�ٽ���A��ˮ
������B��������
��3����������ѧ����ʽ��ʾ����G��������ϵͳ������ԭ��
��4���û�ѧ����ʽ����F���ڷ����ڿ�����ʧЧ��ԭ��
��5������ϸ��˿���������Ҿ���ȼ�գ���������ȼ�ղ�����ɱ�����Һ�����ˮ�п��Եõ��������������壬������������������ֱ����
֮�䣮���������������е������ϡ���ᣬ������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȷ��ʾ���з�Ӧ�����ӷ���ʽ���ǣ�������
A.��Fe��NO3��2ϡ��Һ�м������3Fe2++4H++NO3��=3Fe3++2H2O+NO��
B.ͭ��Ũ���ᷴӦ��Cu+NO3��+4H+=Cu2++NO��+2H2O
C.�Ȼ����Һ��Ũ����������Һ��Ϻ���ȣ�NH4++OH�� ![]() NH3H2O
NH3H2O
D.̼�������Һ����������������Һ��Ϻ���ȣ�NH4++OH�� ![]() NH3��+H2O
NH3��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������У�aA������bB��������ƽ������¶Ȳ��䣬�������������1�������ﵽ��ƽ��ʱ��B��Ũ����ԭ����60%������˵����ȷ���ǣ� ��
A.ƽ�����淴Ӧ�����ƶ���
B.����A��ת���ʼ�����
C.����B����������������
D.a��b
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com