
����Ŀ����֪ʵ�����������ķ�Ӧ��Zn+2HCl=ZnCl2+H2��������13.0gZn����һ����2mol/Lϡ�����ַ�Ӧ��һ��ʱ���Zn����ʣ�࣮
��1����˫���Ż����ű������ת�Ƶķ������Ŀ
��2���Ƚ�H+��Zn2+������ǿ��
��3��������������������������
��4������ZnCl2�����ʵ���Ϊ���٣�
��5����״���£�������ռ������������壿
��6����Ӧ��ת�Ƶĵ��ӵĸ�����
���𰸡�
��1��
��2��H+�����Դ���Zn2+
��3��0.2L
��4��0.2mol
��5��4.48L
��6��0.4mol
���������⣺��1��2HCl+Zn�TZnCl2+H2����ʧ���ӵ�ZnԪ�ػ��ϼ����ߣ��õ��ӵ�HԪ�ػ��ϼ۽��ͣ�ZnΪ��ԭ����HClΪ�����������ϼ۽�����Ŀ=���ϼ�������Ŀ=ת�Ƶĵ�����Ŀ=2������ת��������£�  ��
��
���Դ��ǣ�  ��
��
��2����2HCl+Zn�TZnCl2+H2��ZnΪ��ԭ����H+Ϊ������������Zn2+Ϊ������������������������Դ�����������������ԣ���H+�����Դ���Zn2+����H+�����Դ���Zn2+��
��3��5��п��Ħ��������65g/mol������п�����ʵ�����13.0g��65g/mol=0.2mol��
Zn+ | 2 HCl= | ZnCl2 + | H2�� |
1 | 2 | 1 | 1 |
0.2mol | n��HCl�� | n��ZnCl2�� | n��H2�� |
��n��HCl��= ![]() =0.4mol
=0.4mol
n��ZnCl2��=n��H2��= ![]() =0.2mol
=0.2mol
�����������������0.4mol��2mol/L=0.2L
�����Ȼ�п����������0.2mol��
���������ڱ�״���µ�����ǣ�0.2mol��22.4L/mol=4.48L��
�𣺣�3����������������0.2L��
��4�������Ȼ�п��0.2mol��
��5�����������ڱ�״���µ������4.48L��
��6����  ����0.2molZn���뷴Ӧת�Ƶĵ��ӵĸ���Ϊ2��0.2mol=0.4mol���𣺷�Ӧ��ת�Ƶĵ��ӵĸ���Ϊ0.4mol��
����0.2molZn���뷴Ӧת�Ƶĵ��ӵĸ���Ϊ2��0.2mol=0.4mol���𣺷�Ӧ��ת�Ƶĵ��ӵĸ���Ϊ0.4mol��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̽�ն�Ա���������ᣬ��С���߽��˻�ѧ�Թ�����֪�����߳�������Ϊ�Թ������ࡰ���˵�Ұ�ޡ������������ᷴӦ�����ʻ�����ˮ��Һ�����������ܿ����ǣ��������ͨ����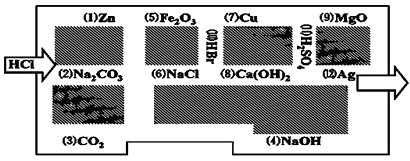
��1������������߳��Թ�������ͼ������ǰ���������������ʾ���ߵ�·�ߣ� ��
��2�����ܡ��Ե�������Ļ�ѧ��Ӧ�У�������ͼ��кͷ�Ӧ������������������ԭ��Ӧ�������������ܡ��Ե������������ �� д���÷�Ӧ�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������10mL0.1molL��1NaOH��Һ�м���0.1molL��1��һԪ��HA����ҺpH�ı仯������ͼ��ʾ������˵����ȷ���ǣ� �� 
A.HAΪǿ��
B.a��b������ʾ��Һ��ˮ�ĵ���̶���ͬ
C.b����ʾ��Һ��c��A������c��HA��
D.pH=7ʱ��c��Na+��=c��A����+c��HA��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ƫ������(C2H8N2)��һ�ָ���ȼ�ϣ�ȼ�ղ���������������Ϊ�������ػ�����ƶ�����������������ȷ����
A��ƫ�����µ�Ħ������Ϊ60 g
B��6.02��1023��ƫ�����·��ӵ�����Ϊ60 g
C��1 molƫ�����µ�����Ϊ60 g/mol
D��6 gƫ�����º���NA��ƫ�����·���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����仯�����ڹ�ҵ����������;�����������Ҫ�ɷ�ΪMg2B2O5H2O����������Fe2O3��FeO��CaO��Al2O3��SiO2�ȣ�Ϊԭ���Ʊ����ᣨH3BO3���Ĺ���������ͼ��ʾ�� 
��֪��Fe3+��Al3+��Fe2+��Mg2+������������ʽ��ȫ����ʱ����Һ��pH�ֱ�Ϊ3.2��4.9��9.7��12.4��
�ش��������⣺
��1��Ϊ��ߡ����������ʣ����ʵ���������Ũ���⣬���ɲ�ȡ�Ĵ�ʩ����
��2��ʵ�����й��˲�������Ҫ�IJ��������У�����������
��3�����������е�����������ѧʽ����
��4�����������ӡ����ȼ�H2O2��Һ�������� �� Ȼ���ٵ�����Һ��pHԼΪ5��Ŀ������
��5���������ᡱ�е���Ҫ�������������ƣ���
��6���������������������������������ܵ���֣�������ͽ���þΪԭ���ڼ��������¿��Ʊ������� �û�ѧ����ʽ��ʾ�Ʊ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ����ȷ����
A��Fe����ϡ���2Fe��6H+ = 2Fe3+ + 3H2��
B����С�մ�����θ����ࣺCO32-��2H+=CO2����H2O
C����FeCl3��Һ��ʴӡˢ��·����ͭ����Fe3+��Cu=Fe2+��Cu2+
D������Ũ����������Һ��Ӧ��2Al��2OH����2H2O=2AlO2-��3H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У��������뻹ԭ����ѧ������Ϊ1��2���ǣ�������
A.Fe+2HCl�TFeCl2+H2��
B.2HCl+Ca��ClO��2�T2HClO+CaCl2
C.I2+2NaClO3�T2NaIO3+Cl2��
D.4HCl��Ũ��+MnO2 ![]() MnCl2+Cl2��+2H2O
MnCl2+Cl2��+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ʵ���������Ƴ��Ľ�����ȷ����
A. Cl2��SO2����ʹƷ����Һ��ɫ��˵�����߾���������
B. ����Һ�еμ��ữ��Ba(NO3)2��Һ���ְ�ɫ������˵������Һ��һ����SO42��
C. Fe��ϡHNO3��ϡH2SO4��Ӧ�������ݲ�����˵��Fe��������������û���Ӧ
D. �ֱ����HCl��NH3����ƿ������ˮ�к�Һ���Ѹ��������˵�����߾�������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����50mLϡH2SO4��ϡHNO3�Ļ����Һ���������ۣ�����������۵����������������������״����֮��Ĺ�ϵ��ͼ��ʾ����ÿһ��ֻ��Ӧһ����Ӧ������˵����ȷ���ǣ�������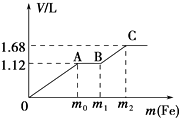
A.��ʼʱ����������ΪH2
B.AB�η����ķ�ӦΪ�û���Ӧ
C.���û����Һ��c��HNO3��=0.5 molL��1
D.�μӷ�Ӧ���۵�������m2=5.6 g
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com