
【题目】某元素原子价电子构型3d54s2,其在周期表中的位置是( )
A. 第四周期ⅦA族 B. 第四周期ⅡB族
C. 第四周期ⅤB族 D. 第四周期ⅦB族
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某温度下,在一容积可变的容器中,反应2A(g)+B(g)2C(g)达到平衡时,A、B和C的物质的质量的量分别为4mol、2mol和4mol,保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
A.均减半
B.均加倍
C.均减少1mol
D.均增加1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种白色晶体,极微溶于水,不溶于醇类。可与水缓慢反应,易与酸反应。实验室通常用CaCl2在碱性条件下与H2O2反应制得(该反应剧烈并大量放热),装置如图所示,请回答下面的问题:
I.CaO2的制备

(1)漏斗在使用时其上口的玻璃塞应________(填“打开”或“关闭”),支管B的作用是________。
(2)将盛有浓CaCl2溶液的装置置于冰水混合物中。其原因是:使反应平稳进行、___________。
(3)加入H2O2与浓氨水的混合溶液,使反应开始。
①反应的化学方程式是_______________。
②滴加H2O2与浓氨水混合溶液之前,还应进行的操作是______。
(4)待反应结束后,经______(填操作)得CaO2粗产品。
Ⅱ.CaO2纯度的测定:将一定量的CaO2溶于稀硫酸,用标准KMnO4溶液滴定生成的H2O2(KMnO4反应后生成Mn2+),计算确定CaO2的含量。
(5)现每次称取0.4000g样品溶解后,用0.1000mol/L的KMnO4溶液滴定,所得的数据如下表所示,则样品的纯度__________。
实验序号 | ① | ② | ③ | ④ |
消耗KMnO4体积/mL | 19.98 | 20.02 | 20.20 | 20.00 |
(6)测得CaO2样品的纯度偏低,其原因可能是______(选填编号)。
A.烘烤时间不足
B.配制KMnO4标准溶液定容时俯视容量瓶刻度线
C.在洁净干燥的酸式滴定管中未润洗即装标准液
D.滴定前尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列每组中各物质内既有离子键又有共价键的一组是( )
A.NaOH、H2SO4、(NH4)2SO4
B.MgO、Na2SO4、NH4HCO3
C.Na2O2、KOH、Na2SO4
D.HCl、Al2O3、MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是大气污染物,可以通过以下方法处理:
I.催化还原法:在汽车排气管上安装一个催化转化器,发生反应:
2NO(g) + 2CO(g) ![]() N2(g) + 2CO2(g) △H1
N2(g) + 2CO2(g) △H1
(1)已知:①N2(g) +O2(g)![]() 2NO(g) △H2=+180kJ/mol
2NO(g) △H2=+180kJ/mol
②CO与O2 反应相关的化学键键能数据如下:
化学键 | O=O | C=O | C≡O |
键能/(kJ/mol) | 497 | 803 | 1072 |
则△H1=__________。
(2)在一定温度下,向容积为1L的密闭容器中充入2 molNO、1molCO,10min时反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g)达到平衡状态,反应过程中反应物浓度随时间变化情况如图1所示:
N2(g)+2CO2(g)达到平衡状态,反应过程中反应物浓度随时间变化情况如图1所示:
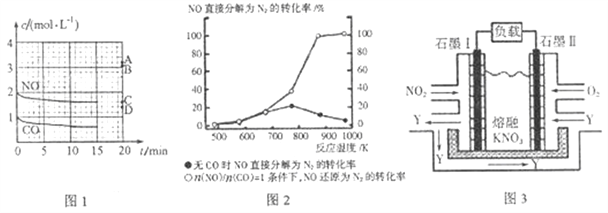
①该反应的平衡常数K=______(结果保留3位有效数字);前10min内用氮气表示的平均反应速率为______。
②若保持其他条件不变,15min时再向该容器中充入少量N2,则此时反应的v正______ v逆(填“>”、“=”或“<”),原因是____________。
③若保持其他条件不变,15min时压缩容器的容积至0.5L,20min时反应重新达到平衡,则此时NO的浓度对应的点应是图1中的______(填字母)。
④某科研小组研究发现以Ag-ZSM-5为催化剂,NO转化为N2的转化率随温度变化情况如图2 所示。若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因是______。
II.利用电化学原理,将NO2、O2 和熔融KNO3制成燃料电池,其原理如图3。
(3)该电池在工作过程中NO2转变成绿色硝化剂Y,Y 是一种氧化物,可循环使用,石墨I附近发生的电极反应式为______。相同条件下,消耗的O2 和NO2 的体积比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,不能与CO2发生反应的是( )。
①Na2O ②Na2O2 ③NaCl ④NaOH ⑤NaHCO3
A.①④B.②③C.③⑤D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是
A.明矾易溶于水,可用作净水剂
B.Al2O3熔点高,可用于制作耐火材料
C.HClO具有弱酸性,可用于漂白、消毒
D.Al(OH)3高温会分解,可用于治疗胃酸过多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com