
【题目】25℃时,向 20 mL 0.1 mol/L NaOH 溶液中逐滴加入 0.1 mol/L 醋酸溶液,滴定曲线如图所示。下列说法正确的是
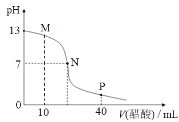
A.该NaOH 溶液中水电离出的 c(OH-)=1×10-12 mol/L
B.M 点时,c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C.P 点时,c(CH3COO-)+c(CH3COOH)=2c(Na+)
D.N 点对应的横坐标是 20
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】相同温度、相同浓度的六种溶液,其pH由小到大的顺序如图所示,图中①②③代表的物质可能分别是
![]()
A.NH4Cl (NH4)2SO4 CH3COONa
B.(NH4)2SO4 NH4Cl CH3COONa
C.(NH4)2SO4 NH4Cl NaOH
D.CH3COOH NH4Cl (NH4)2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素的核电荷数依次增大,它们的简单离子的电子层数相同且最外层电子数均为8。A原子的L层电子数与K、M层电子数之和相等,D原子的K、L层电子数之和等于其电子总数的一半。
请回答下列问题:
(1)四种元素的元素符号依次是A________B________C________D________。它们的原子半径由大到小的顺序是________________(用元素符号表示)。
(2)试写出四种元素的简单离子结构示意图A________B________C________D________。它们的离子半径由大到小的顺序是________________(用元素符号表示)
(3)A、B、C、D的最高价氧化物对应水化物的化学式分别是________________,分别比较其最高价氧化物对应水化物酸性和碱性的强弱________________。
(4)写出其中非金属元素形成的气态氢化物的化学式:________,其稳定性强弱是_________,理由是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】解释下列过程的离子方程式不正确的是
A.K2Cr2O7 溶液中加入浓 NaOH 溶液后变黄:![]() +H2O
+H2O![]() 2
2![]() +2H+
+2H+
B.明矾溶于水产生Al(OH)3 胶体:Al3++3H2O![]() Al(OH)3(胶体)+3H+
Al(OH)3(胶体)+3H+
C.用碳酸钠溶液处理锅炉水垢中的硫酸钙:CaSO4+![]() ==CaCO3+
==CaCO3+![]()
D.向Ca(HCO3)2 溶液中滴加少量 NaOH 溶液生成白色沉淀:Ca2++2![]() +2OH-=CaCO3↓+
+2OH-=CaCO3↓+![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油脂是重要的营养物质.某天然油脂A可发生下列反应:

已知:A的分子式为C57H106O6.1mol该天然油脂A经反应①可得到1molD、1mol不饱和脂肪酸B和2mol直链饱和脂肪酸C.经测定B的相对分子质量为280,原子个数比为C:H:O=9:16:1;
(1)写出B的分子式:________________________;
(2)写出反应①的反应类型:____________;C的名称(或俗称)是_________;
(3)近日,电视媒体关于“氢化油危害堪比杀虫剂”的报道引发轩然大波,反应②为天然油脂的氢化过程.下列有关说法不正确的是_______________;
a.氢化油又称人造奶油,通常又叫硬化油.
b.植物油经过氢化处理后会产生副产品反式脂肪酸甘油酯,摄入过多的氢化油,容易堵塞血管而导致心脑血管疾病.
c.氢化油的制备原理是在加热植物油时,加入金属催化剂,通入氢气,使液态油脂变为半固态或固态油脂.
d.油脂的氢化与油脂的皂化都属于加成反应
(4)D和足量金属钠反应的化学方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应 mY(g)+nZ(g)qX(g) ΔH,在不同温度下的平衡体系中,物质 Y 的体积分数随压强变化的曲线如图所示。下列说法正确的是
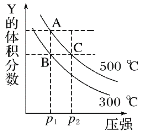
A.m+n<q
B.该反应的ΔH>0
C.A、C 两点化学平衡常数:KA>KC
D.B、C 两点的反应速率:v(B)<v(C)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是元素周期表的一部分,请用元素符号、离子符号或相关化学式回答有关问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)表中能形成两性氢氧化物的元素在周期表中的位置是________;
(2)写出②的气态氢化物的结构式________;
(3)元素④⑤⑥⑦离子半径由大到小的顺序________;
(4)①、⑥、⑦三种元素的最高价氧化物的水化物中酸性最强的是________;④、⑤、⑨三种元素的最高价氧化物的水化物中碱性最强的是
(5)⑦和⑩氧化性较强的是________用一个置换反应证实这一结论(写化学方程式)___________________________。
(6)④⑤两元素相比较,金属性较强的是________,可以验证该结论的实验是________;
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将形状、大小相同的这两种元素的单质用砂纸打磨后分别和同浓度的盐酸反应
(c)将形状、大小相同两种元素的单质用砂纸打磨后分别和热水作用,并滴入酚酞
(d)比较这两种元素的气态氢化物的稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
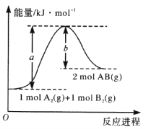
A. 每生成2 mol AB吸收bkJ热量
B. 该反应热△H= + (a-b)kJ mol-1
C. 该反应中反应物的总能量高于生成物的总能量
D. 断裂1 mol A—A和1 mol B—B键,放出akJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
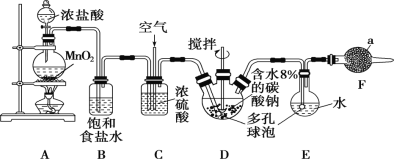
【题目】Cl2O为国际公认的高效安全灭菌消毒剂之一,实验室可利用氯气和空气(氯气与空气体积比为1∶3,空气不参与反应)的混合气与含水8%的碳酸钠反应制备,并用水吸收Cl2O制备次氯酸溶液,所用实验装置和Cl2O的性质如下:
颜色 | 棕黄色 |
状态 | 气体 |
气味 | 强刺激性 |
熔点 | -116 ℃ |
沸点 | 3.8 ℃ |
水溶性 | 极易溶于水,与水反应生成次氯酸 |
热稳定性 | 42 ℃以上分解为Cl2和O2 |
(1)仪器a的名称为________,所盛放的药品是________。
(2)写出装置A中发生反应的离子方程式:_______________。
(3)装置C的主要作用是___________。
(4)装置D、E中都用到多孔球泡,其作用是____________。
(5)写出装置D中Cl2与过量碳酸钠反应生成Cl2O的化学方程式:________。
(6)装置E采用棕色圆底烧瓶的原因是____________。
(7)制备Cl2O装置中存在缺陷,请提出改进措施:___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com