
| A.①③ | B.②④ | C.①④ | D.②③ |
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源:不详 题型:填空题
 ,具有抗癌作用;反铂的结构式为
,具有抗癌作用;反铂的结构式为 ,无抗癌作用。
,无抗癌作用。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na与乙醇反应时断裂的是H-O键 |
| B.在浓硫酸作用下加热到170℃时断裂的是C-O键和甲基中的C-H键 |
| C.在Cu作催化剂和氧气反应时断裂的是H-O键和“CH2”中的C-H键 |
| D.和乙酸发生酯化反应时断裂的是C-O键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.干冰、SiCl4熔化时不需要破坏化学键 |
| B.32gS8分子含8molS-S共价键 |
| C.H2S和CS2分子都是含极性键的极性分子 |
| D.PCl3和BCl3分子中所有原子的最外层都达到8电子结构 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2O(g)→H2O(l)+44.0kJ/mol |
| B.2HI(g)→H2(g)+I2(g)-14.9kJ/mol |
| C.浓硫酸溶于水 |
| D.能量变化如图所示的化学反应 |
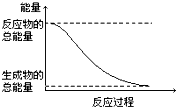
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②④ | B.①④⑤ | C.②③⑤ | D.除③以外 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g);△H=-dJ·mol-1(d>0)。初始投料与各容器达到平衡时的有关数据如下:
CH3OH(g);△H=-dJ·mol-1(d>0)。初始投料与各容器达到平衡时的有关数据如下:| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2 molH2、1 molCO | 1 mol CH3OH | 4 molH2、2 molCO |
| 平衡时n(CH3OH ) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com