
【题目】(1)加热13.7g Na2CO3和NaHCO3的混合物至质量不再变化,恢复至室温,剩余固体的质量为10.6g,则混合物中NaHCO3的物质的量为___________。
(2)根据反应8NH3 + 3Cl2=N2+ 6NH4Cl,回答下列问题:
①该反应中______元素被还原,______元素被氧化;
②在该反应中,若有0.3mol电子发生转移,在标准状况下,可生成N2的体积为______L。
【答案】0.1mol Cl N 1.12
【解析】
(1) NaHCO3不稳定,加热分解产生Na2CO3、H2O、CO2,反应方程式为:2NaHCO3![]() Na2CO3+CO2↑+H2O,根据方程式可知:每有2mol NaHCO3分解,固体质量会减轻44g+18g=62g,现在固体质量减轻了13.7g-10.6g=3.1g,则混合物中NaHCO3的物质的量为n(NaHCO3)=
Na2CO3+CO2↑+H2O,根据方程式可知:每有2mol NaHCO3分解,固体质量会减轻44g+18g=62g,现在固体质量减轻了13.7g-10.6g=3.1g,则混合物中NaHCO3的物质的量为n(NaHCO3)=![]() ;
;
(2)①在反应8NH3+3Cl2=N2+ 6NH4Cl中,Cl元素的化合价由反应前Cl2中的0价变为反应后NH4Cl中的-1价,化合价降低,获得电子,被还原;N元素的化合价由反应前NH3中的-3价变为反应后N2中的0价,化合价升高,失去电子,被氧化;
②由8NH3+3Cl2=N2+ 6NH4Cl可知:每反应产生1mol N2,转移6mol电子,则有0.3mol电子发生转移,反应产生氮气的物质的量为n(N2)=![]() ,在标准状况下其体积为V(N2)=nVm=0.05mol×22.4L/mol=1.12L。
,在标准状况下其体积为V(N2)=nVm=0.05mol×22.4L/mol=1.12L。


科目:高中化学 来源: 题型:
【题目】根据以下背景资料,回答下列问题:
Ⅰ、不锈钢以其优异的抗腐蚀性能越来越受到人们的靑睐,它主要是由铁、铬、镍、铜、碳等元索所组成的合金。
Ⅱ、锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。
Ⅲ、砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。
Ⅳ、K2Cr2O7曾用于检测司机是否酒后驾驶:
Cr2O72-(橙色)+CH3CH2OH![]() Cr3+(绿色)+CH3COOH (未配平)
Cr3+(绿色)+CH3COOH (未配平)
(1)镍元素基态原子的电子排布式为_________________。
(2)CH3COOH分子中所含元素的电负性由大到小的顺序为___________,碳原子的轨道杂化类型为_________,所含σ键与π键的数目之比为______________________。
(3)AsCl3分子的立体构型为_____________,铁原子中有_________个未成对电子。
(4)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液,在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的原子是_____。
(5)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因____________________。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | 49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(6)某镍白铜合金的立方晶胞结构如图所示。
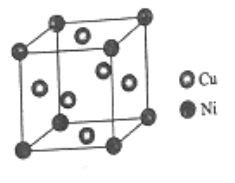
①晶胞中铜原子与镍原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】组成玉米的主要元素是
A. C、H、Ca、K、Mg、B B. N、P、S、Zn、Cu、Mn
C. C、H、O、P、S、N D. H、O、Fe、B、Zn、Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年诺贝尔化学奖授予美籍华裔钱永健等三位科学家,以表彰他们发现和研究了绿色荧光蛋白。荧光素是发光物质的基质, 5-羧基荧光素与5-羧基二乙酸荧光素在碱性条件下有强烈的绿色荧光,它们广泛应用于荧光分析等。( )

![]()
下列说法不正确的是 ( )
A. 5-FAM转变为5-CFDA属于取代反应
B. 5-FAM的分子式为C21H12O7
C. 5-FAM和5-CFDA 各1mol分别与足量NaOH溶液反应,5-CFDA消耗的NaOH 物质的量多
D. 实验室鉴别5-FAM与5-CFDA可用NaHCO3 溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连翘是临床上常见的一种中药,其有效成分中的连翘酚(C15H18O7)具有抗菌作用。连翘酚属于
A. 单质B. 氧化物C. 无机物D. 有机化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸具有较广泛的抑菌作用,结构简式为![]() 。下列有关说法中正确的是
。下列有关说法中正确的是
A. 该物质可以发生水解反应
B. 可以用酸性高锰酸钾溶液检验碳碳双键
C. 1 mol咖啡酸与足量钠、碳酸氢钠溶液反应,在相同条件下生成气体的体积比为1∶2
D. 1 mol咖啡酸可与4 mol Br2发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作与说法正确的是( )
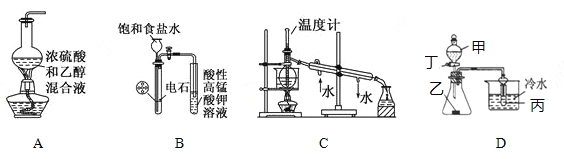
A. 实验室制乙烯
B. 实验室制乙炔并验证乙炔能发生氧化反应
C. 实验室中分馏石油
D. 若甲为醋酸,乙为贝壳(粉状),丙为苯酚钠溶液,则该装置不可以验证醋酸、碳酸、苯酚酸性的强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
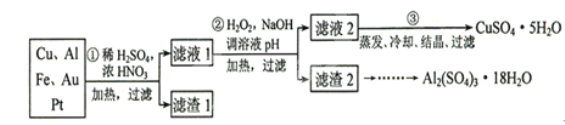
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为___________________________;得到滤渣1的主要成分为__________________________.
(2)第②步加H2O2的作用是_______________;调溶液pH的目的是使______________生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是____________。
(4)探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol· L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2+ + H2Y2- = CuY2- + 2H+。写出计算CuSO4·5H2O质量分数的表达式ω=_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,能在溶液中大量共存的是
A. H+ 、Ca2+ 、Cl—、CO3— B. Na+ 、Mg2+、SO42—、OH-
C. K+ 、Na+ 、OH-、Cl— D. Cu2+ 、Ba2+、Cl—、SO42—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com