
【题目】信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
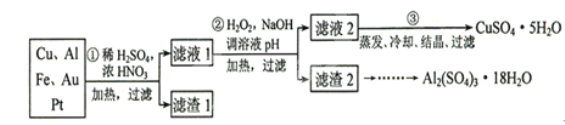
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为___________________________;得到滤渣1的主要成分为__________________________.
(2)第②步加H2O2的作用是_______________;调溶液pH的目的是使______________生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是____________。
(4)探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol· L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2+ + H2Y2- = CuY2- + 2H+。写出计算CuSO4·5H2O质量分数的表达式ω=_____________________
【答案】Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O;3Cu+2NO3-+8H+ =3Cu2++2NO↑+4H2OAu、Pt将Fe2+氧化为Fe3+; Fe3+、Al3+;加热脱水![]()
【解析】
(1)浓硝酸与稀硫酸混合,硝酸可能为浓溶液,也可能为稀溶液,所以两个离子方程式都可;Au、P他不和硝酸反应,所以滤渣1的主要成分为:Au、Pt。故答案为:Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O或3Cu+2NO3-+8H+ =3Cu2++2NO↑+4H2O;Au、Pt;(2)第②步加H2O2的作用是把Fe2+氧化为Fe3+;调溶液PH的目的是使Fe3+和Al3+形成沉淀。故答案为:将Fe2+氧化为Fe3+; Fe3+、Al3+;(3)第③步由五水硫酸铜制备硫酸铜的方法应是在坩埚中加热脱水。故答案为:加热脱水;(4)滴定反应为:Cu2++H2Y2-=CuY2-+2H+,铜离子物质的量和标准液物质的量相同:cmol/L×b×10-3L=bc×10-3mol;依据元素守恒可得:20ml溶液中含有的CuSO4·5H2O物质的量为:bc×10-3mol,则100ml溶液中含硫酸铜晶体的物质的量为:bc×10-3mol×5=5bc×10-3mol;所以CuSO4·5H2O质量分数的表达式为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】20℃时,NaCl溶解于水的实验数据如下表所示
实验序号 | 水的质量/g | 加入的NaCl质量/g | 未溶的NaCl质量/g |
10 | 2 | 0 | |
10 | 3 | 0 | |
10 | 4 | 0.4 |
下列叙述正确的是( )
A. 实验①所得的溶液为饱和溶液 B. 实验②所得的溶液为饱和溶液
C. 20℃时NaCl的溶解度为30g D. 实验①所得溶液的溶质质量分数为16.7%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)加热13.7g Na2CO3和NaHCO3的混合物至质量不再变化,恢复至室温,剩余固体的质量为10.6g,则混合物中NaHCO3的物质的量为___________。
(2)根据反应8NH3 + 3Cl2=N2+ 6NH4Cl,回答下列问题:
①该反应中______元素被还原,______元素被氧化;
②在该反应中,若有0.3mol电子发生转移,在标准状况下,可生成N2的体积为______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性澄清透明溶液中,下列各组离子能大量共存的是( )
A.Cu2+、Mg2+、NO3-、Cl-B.Ag+、Na+、NO3-、Cl-
C.K+、Ca2+、SO42-、Cl-D.Na+、Ba2+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 碳酸氢钠常用于治疗胃酸过多症
B. 切开的金属Na暴露在空气中,光亮表面会逐渐变暗
C. 发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔
D. 金属钠着火时,可以使用泡沫灭火器来灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学化学常见物质,且均含有同一种元素,它们之间有如图所示的转化关系,其中A是单质.
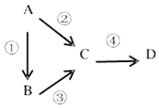
(1)若A是一种淡黄色固体,B是气态氢化物,C、D为气态氧化物,C是形成酸雨的主要物质.请写出C与B反应的化学方程式___________________.
(2)若B是气态氢化物,C、D为气态氧化物,且C.D是形成光化学烟雾的一个重要原因.请写出反应③的化学方程式______________________.实验室中检验气体B用的试剂或用品为________.
(3)若B、D既能溶于强酸溶液,又能溶于强碱溶液,反应②③均需要强碱性溶液,反应④可以通过滴加少量稀盐酸实现,请写出②的离子方程式_________
(4)若C是一种淡黄色固体,常用于呼吸面具中的供氧剂,D是一种强碱.则C做供氧剂时与CO2反应的氧化产物和还原产物的物质的量之比为______;焰色反应时,D的火焰呈________色.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出)。请根据以上信息回答下列问题:
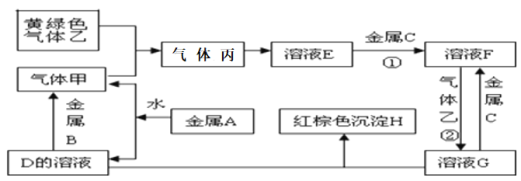
(1)写出下列物质的化学式:乙_________、H__________;
(2)写出反应②的离子方程式______________________;
(3)写出金属A与水反应的离子方程式___________________________;
(4)写出金属B与D的溶液反应的离子方程式____________________;
(5)F与D溶液反应后的产物在空气中转化为H的化学方程式___________;现象为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯在自然界以化合物形态存在,18世纪70年代,首先发现并制得氯气的化学家是 ( )
A. 汉弗莱·戴维 B. 舍勒 C. 阿伏加德罗 D. 侯德榜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com