
����Ŀ��A��B��C��D��Ϊ��ѧ��ѧ�������ʣ��Ҿ�����ͬһ��Ԫ�أ�����֮������ͼ��ʾ��ת����ϵ������A�ǵ��ʣ�
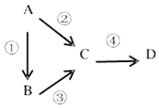
��1����A��һ�ֵ���ɫ���壬B����̬�⻯�C��DΪ��̬�����C���γ��������Ҫ���ʣ���д��C��B��Ӧ�Ļ�ѧ����ʽ___________________��
��2����B����̬�⻯�C��DΪ��̬�������C��D���γɹ⻯ѧ������һ����Ҫԭ����д����Ӧ���Ļ�ѧ����ʽ______________________��ʵ�����м�������B�õ��Լ�����ƷΪ________��
��3����B��D��������ǿ����Һ����������ǿ����Һ����Ӧ�ڢ�����Ҫǿ������Һ����Ӧ������ͨ���μ�����ϡ����ʵ�֣���д���������ӷ���ʽ_________
��4����C��һ�ֵ���ɫ���壬�����ں�������еĹ�������D��һ��ǿ���C��������ʱ��CO2��Ӧ����������ͻ�ԭ��������ʵ���֮��Ϊ______����ɫ��Ӧʱ��D�Ļ����________ɫ��
���𰸡�SO2+2H2S=3S+2H2O 4NH3+5O2 ![]() 4NO+6H2O ʪ��ĺ�ɫʯ����ֽ(պ��Ũ����IJ�����������������) 2Al+2OH��+2H2O=2AlO2��+3H2�� 1��2 ��
4NO+6H2O ʪ��ĺ�ɫʯ����ֽ(պ��Ũ����IJ�����������������) 2Al+2OH��+2H2O=2AlO2��+3H2�� 1��2 ��
��������
��1����A��һ�ֵ���ɫ���壬��AΪS���ݴ˽��
��2��B����̬�⻯�C��DΪ��̬�������C��D���γɹ⻯ѧ������һ����Ҫԭ����CΪNO��AΪN2��BΪNH3��DΪNO2��
��3��B��D��������ǿ����Һ����������ǿ����Һ����Ӧ�ڢ۾���Ҫǿ������Һ����Ӧ�ܿ���ͨ���μ�����ϡ����ʵ�֣���AΪAl��BΪAl2O3��DΪAl��OH��3��
��4��C��һ�ֵ���ɫ���壬��������������еĹ�������D��һ��ǿ���CΪNa2O2��DΪNaOH��
��1����A��һ�ֵ���ɫ���壬B����̬�⻯�C��DΪ��̬�������C���γ��������Ҫ���ʣ�CΪSO2����AΪS��BΪH2S��DΪSO3��C��B��Ӧ����S��ˮ���仯ѧ��Ӧ����ʽΪSO2+2H2S=3S+2H2O��
��2��B����̬�⻯�C��DΪ��̬�������C��D���γɹ⻯ѧ������һ����Ҫԭ����CΪNO��AΪN2��BΪNH3��DΪNO2����Ӧ�۵Ļ�ѧ����ʽΪ4NH3+5O2 ![]() 4NO+6H2O�����鰱��������ʪ��ĺ�ɫʯ����ֽ��պ��Ũ����IJ�������
4NO+6H2O�����鰱��������ʪ��ĺ�ɫʯ����ֽ��պ��Ũ����IJ�������
��3��B��D��������ǿ����Һ����������ǿ����Һ����Ӧ�ڢ۾���Ҫǿ������Һ����Ӧ�ܿ���ͨ���μ�����ϡ����ʵ�֣���AΪAl��BΪAl2O3��CΪƫ�����Σ�DΪAl��OH��3���ڵ����ӷ���ʽΪ2Al+2OH��+2H2O=2AlO2��+3H2����
��4��C��һ�ֵ���ɫ���壬��������������еĹ�������D��һ��ǿ���CΪNa2O2��DΪNaOH��A���ƣ�B�������ƣ��������ƺͶ�����̼��Ӧ�Ļ�ѧ����ʽΪ��2Na2O2+2CO2=2Na2CO3+O2��Ԫ�ػ��ϼ�����ʧ���ӷ���������Ӧ���õ��������Ԫ�ػ��ϼ۽��͵õ����ӷ�����ԭ��Ӧ���õ���ԭ�����˹������Ƽ���������Ҳ�ǻ�ԭ��������������ͻ�ԭ��������ʵ���֮��Ϊ1��2����ɫ��Ӧʱ���������ƵĻ���ʻ�ɫ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ҪԪ����
A. C��H��Ca��K��Mg��B B. N��P��S��Zn��Cu��Mn
C. C��H��O��P��S��N D. H��O��Fe��B��Zn��Mg
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������װ�û������˵����ȷ���ǣ� ��
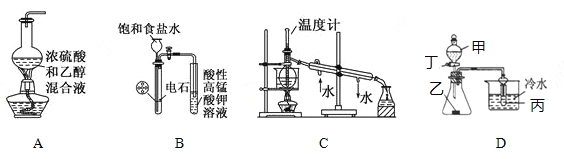
A. ʵ��������ϩ
B. ʵ��������Ȳ����֤��Ȳ�ܷ���������Ӧ
C. ʵ�����з���ʯ��
D. ����Ϊ���ᣬ��Ϊ����(��״),��Ϊ��������Һ�����װ�ò�������֤���ᡢ̼�ᡢ�������Ե�ǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ϣʱ�������Ĵ������������Ի��������˼������в��ij�����Ϊ����ѧ��̽��С�齫һ����������·������õ���70%Cu��25%Al��4%Fe������Au��Pt�Ƚ����Ļ�������Ƴ������Ʊ�����ͭ�������������·�ߣ�
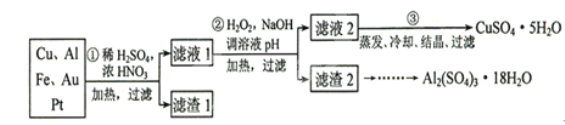
��ش��������⣺
��1���ڢٲ�Cu���ᷴӦ�����ӷ���ʽΪ___________________________���õ�����1����Ҫ�ɷ�Ϊ__________________________.
��2���ڢڲ���H2O2��������_______________������ҺpH��Ŀ����ʹ______________���ɳ�����
��3���õڢ۲�����CuSO4��5H2O�Ʊ���ˮCuSO4�ķ�����____________��
��4��̽��С���õζ����ⶨCuSO4��5H2O��Mr��250��������ȡa g�������100 mL��Һ��ÿ��ȡ20.00 mL�������������Ӻ���c mol�� L-1 EDTA��H2Y2��������Һ�ζ����յ㣬ƽ������EDTA��Һb mL���ζ���Ӧ���£�Cu2+ + H2Y2�� �� CuY2�� + 2H+��д������CuSO4��5H2O���������ı���ʽ�أ�_____________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������и�װ��ͼ�������У���ȷ����
A. ��ȡ���۲�Fe��OH��2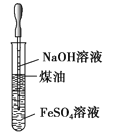
B. �Ƚ��������ʵ����ȶ���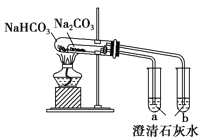
C. ʵ������ȡNH3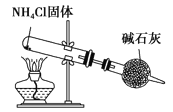
D. ����е㲻ͬ�һ��ܵ�Һ������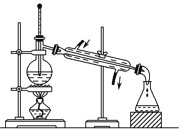
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Ag+��Cl-��Ӧ�����Ȼ���,ÿ�������ɵ��Ȼ�����10%����ֽ�ɵ�����������,�����ֿ�����ˮ��Һ������HClO3��HCl,���γɵ�Cl-��ʣ���Ag+�����������Ȼ���,����ѭ������ֱ������.
��1������д������������Ӧ�Ļ�ѧ����ʽ�������ӷ�Ӧ��д���ӷ���ʽ��____________________ ��
��2������1.1molNaCl����Һ,������������������Һ,������������___��������(�����Ȼ���)
��3�������Һ���ΪlL,��H+�����ʵ���Ũ��Ϊ___ mol��L��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ǿ������ɫ����Һ�������и��������ܴ������������ ��
A. Fe3+��K+��Cl����MnO4�� B. Ag+��Na+��NO3����Cl��
C. Zn2+��Al3+��SO42����Cl�� D. Ba2+��NH4+��Cl����HCO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ӣ�������Һ�д����������
A. H+ ��Ca2�� ��Cl����CO3�� B. Na+ ��Mg2+��SO42����OH��
C. K+ ��Na+ ��OH����Cl�� D. Cu2+ ��Ba2����Cl����SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�����ʵ���Ũ�ȵ�NaOH��Һʱ�����������ҺŨ��ƫ�ߵ�ԭ���ǣ� ��
A.����NaOH������
B.������Һʱ����ƿ�в�����������ˮ
C.������NaOH��Һ�������ձ���
D.������ƿ��ˮʱ�۾�һֱ����Һ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com