
【题目】已知Ag+与Cl-反应生成氯化银,每次新生成的氯化银有10%见光分解成单质银和氯气,氯气又可以在水溶液中生成HClO3和HCl,而形成的Cl-与剩余的Ag+作用又生成氯化银,这样循环往复直到最终.
(1)依次写出上述各步反应的化学方程式(是离子反应的写离子方程式)____________________ 。
(2)现有1.1molNaCl的溶液,加入足量的硝酸银溶液,问最终能生成___克难溶物(银和氯化银)
(3)最后溶液体积为lL,则H+的物质的量浓度为___ mol·L-1。
【答案】Ag++Cl-===AgCl↓ 2AgCl![]() 2Ag+Cl2↑3Cl2+3H2O===6H++ClO3-+5Cl- Ag++Cl-===AgCl↓ 167.94 0.12
2Ag+Cl2↑3Cl2+3H2O===6H++ClO3-+5Cl- Ag++Cl-===AgCl↓ 167.94 0.12
【解析】
(1)依据反应物和生成物,利用质量守恒定律书写相关的方程式;
(2)(3)利用氯化银的分解率借助于总反应式解答。
(1)Ag+与Cl-反应生成氯化银沉淀,离子方程式为Ag++Cl-=AgCl↓;新生成的氯化银见光分解成单质银和氯气,反应的化学方程式为2AgCl![]() 2Ag+Cl2↑;氯气在水溶液中与水反应生成HClO3和HCl,反应的离子方程式为3Cl2+3H2O=6H++ClO3-+5Cl-;生成的Cl-与剩余的Ag+作用又生成氯化银沉淀,反应的离子方程式为Ag++Cl-=AgCl↓。
2Ag+Cl2↑;氯气在水溶液中与水反应生成HClO3和HCl,反应的离子方程式为3Cl2+3H2O=6H++ClO3-+5Cl-;生成的Cl-与剩余的Ag+作用又生成氯化银沉淀,反应的离子方程式为Ag++Cl-=AgCl↓。
(2)由于每次新生成的氯化银有10%见光分解成单质银和氯气,反应依次是
①60Ag++60Cl-=60AgCl↓
②6AgCl![]() 6Ag+3Cl2↑
6Ag+3Cl2↑
③3Cl2+3H2O=6H++ClO3-+5Cl-
①+②+③可得60Ag++55Cl-+3H2O=54AgCl↓+6Ag↓+6H++ClO3-
因此含1.1molNaCl的溶液中加入足量的硝酸银溶液后最终能生成难溶物的质量是![]() ;
;
(3)根据以上分析可知如果最后溶液体积为lL,则H+的物质的量浓度为![]() =0.12mol·L-1。
=0.12mol·L-1。


科目:高中化学 来源: 题型:
【题目】某溶液中可能含有大量的Mg2+、Al3+、H+、Cl-和少量OH-,向该溶液中逐滴加入0.5 mol·L-1NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积之间的关系如下图所示,则可判断原溶液中( )
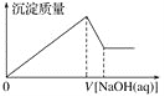
A. 有Mg2+,没有Al3+
B. 有Al3+,没有Mg2+
C. 有Mg2+和Al3+
D. 有大量的H+、Mg2+和Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 碳酸氢钠常用于治疗胃酸过多症
B. 切开的金属Na暴露在空气中,光亮表面会逐渐变暗
C. 发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔
D. 金属钠着火时,可以使用泡沫灭火器来灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学化学常见物质,且均含有同一种元素,它们之间有如图所示的转化关系,其中A是单质.
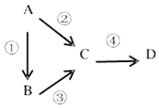
(1)若A是一种淡黄色固体,B是气态氢化物,C、D为气态氧化物,C是形成酸雨的主要物质.请写出C与B反应的化学方程式___________________.
(2)若B是气态氢化物,C、D为气态氧化物,且C.D是形成光化学烟雾的一个重要原因.请写出反应③的化学方程式______________________.实验室中检验气体B用的试剂或用品为________.
(3)若B、D既能溶于强酸溶液,又能溶于强碱溶液,反应②③均需要强碱性溶液,反应④可以通过滴加少量稀盐酸实现,请写出②的离子方程式_________
(4)若C是一种淡黄色固体,常用于呼吸面具中的供氧剂,D是一种强碱.则C做供氧剂时与CO2反应的氧化产物和还原产物的物质的量之比为______;焰色反应时,D的火焰呈________色.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列所配溶液浓度为1mol/L的是( )
A. 将31g Na2O溶于1L水中 B. 常温下,将22.4LHCl溶于水中,配成1L溶液
C. 将100mL5mol/L的KNO3溶液加水称释至500mL D. 将10mL10mol/L的H2SO4溶液与90mL水混合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出)。请根据以上信息回答下列问题:
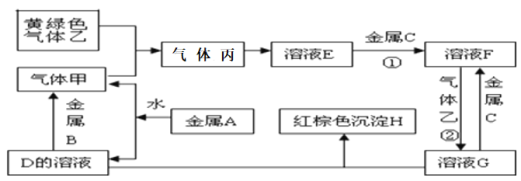
(1)写出下列物质的化学式:乙_________、H__________;
(2)写出反应②的离子方程式______________________;
(3)写出金属A与水反应的离子方程式___________________________;
(4)写出金属B与D的溶液反应的离子方程式____________________;
(5)F与D溶液反应后的产物在空气中转化为H的化学方程式___________;现象为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F 六种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6 L H2,E的阳离子与A的阴离子核外电子层结构完全相同,F原子半径在短周期元素中最大,回答下列问题:
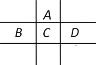
(1)元素的名称:B_____________;
(2)画出C离子的结构示意图:______________;
(3)写出D元素在周期表中的位置:__________;D元素的单质可用于制漂白液和漂白粉,写出制漂白液的离子方程式:____________,漂白粉的有效成分是______________;
(4)B的同族上一周期元素的氢化物为__________(化学式) ,实验室制取该物质的方程式为_________,制取该气体时用______________做干燥剂。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是 ( )

A. 31d和33d属于同种核素
B. 气态氢化物的稳定性:a>d>e
C. b、c、d、e四种元素中都存在能促进水的电离的含氧酸盐
D. e和其它四种元素均能形成共价化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com