
以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备二氧化氯气体,再用水吸收获得二氧化氯溶液。在此过程中需要控制适宜的温度, 若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2气体的吸收率。具体情况如图所示。请回答下列问题

(1)据图可知,反应时需要控制的适宜温度是 ℃,达到此要求采取的适宜措施是 。
(2)已知:黄铁矿中的硫元素在酸性条件下被ClO3-氧化成SO42-,写出制备二氧化氯的离子方程式: 。
(3)某校化学学习小组拟以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标。若取NaClO3样品质量6.0g,通过反应和吸收可得400 mL ClO2溶液,取出20 mL,加入37.00 mL 0.500 mol· (NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500 mol·
(NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500 mol· K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下:
K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下:
4H++ClO2+5Fe2+= +5Fe3+ +2H2O 14H+ +
+5Fe3+ +2H2O 14H+ + +6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O
+6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O
试计算ClO2的“产率”。(写出计算过程)
(1)30℃,水浴加热(或水浴控制恒温);(2)15ClO3-+FeS2+14H+=15ClO2+Fe3++7H2O+2SO42-
(3)与K2Cr2O7反应的n(Fe2+)=6n(Cr2O72-)=6×20×10-3L×0.0500mol/L=6×10-3mol;
与ClO2反应的n(Fe2+)=37×10-3L×0.0500mol/L-6×10-3mol=1.25×10-2mol
n(ClO2)= ×1.25×10-2mol=2.5×10-3mol
×1.25×10-2mol=2.5×10-3mol
ClO2的产率=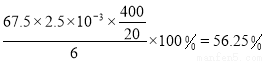
【解析】
试题分析:(1)据图可知,在20℃反应时ClO2气体制取纯度高,但是气体的吸收率较低,在30℃无论是反应制取ClO2气体纯度高还是气体的吸收率都较高。若温度再升高,制取ClO2气体纯度高还是气体的吸收率都降低。所以需要控制的适宜温度是30℃。达到此要求采取的适宜措施是水浴加热(或水浴控制恒温)。(3)由方程式4H++ClO2+5Fe2+=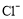 +5Fe3+ +2H2O 14H+ +
+5Fe3+ +2H2O 14H+ +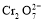 +6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O可结合电子得失守恒可得1×n(Fe2+)=5×n(ClO2)+2×3×n(Cr2O72-).与K2Cr2O7反应的n(Fe2+)=6n(Cr2O72-)=6×20×10-3L×0.0500mol/L=6×10-3mol;与ClO2反应的n(Fe2+)=37×10-3L× 0.0500mol/L -6×10-3mol=1.25×10-2mol。所以n(ClO2)=
+6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O可结合电子得失守恒可得1×n(Fe2+)=5×n(ClO2)+2×3×n(Cr2O72-).与K2Cr2O7反应的n(Fe2+)=6n(Cr2O72-)=6×20×10-3L×0.0500mol/L=6×10-3mol;与ClO2反应的n(Fe2+)=37×10-3L× 0.0500mol/L -6×10-3mol=1.25×10-2mol。所以n(ClO2)= ×1.25×10-2mol=2.5×10-3mol。ClO2的“产率”=
×1.25×10-2mol=2.5×10-3mol。ClO2的“产率”=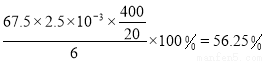 。
。
考点:考查反应条件的选择及采取的方法、氧化还原反应中的电子守恒、物质的产率的计算的知识。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015届江苏省淮安市协作体高二下学期期中考试化学试卷(解析版) 题型:填空题
在稀氨水中存在下述电离平衡NH3+H2O NH3 ·H2O
NH3 ·H2O NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”“减小”或“不变”);平衡移动方向如何?(填“正向”“逆向”或“不移动”)
NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”“减小”或“不变”);平衡移动方向如何?(填“正向”“逆向”或“不移动”)
加入的物质 | 少量(NH4)2SO4固体 | 少量HNO3溶液 | 少量KOH溶液 |
c(OH-)的变化 |
|
|
|
平衡移动方向 |
|
|
|
查看答案和解析>>
科目:高中化学 来源:2015届江苏省沭阳县高二下学期期中调研测试化学试卷(解析版) 题型:选择题
结构为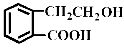 的有机物可以通过不同的反应得到下列四种物质:
的有机物可以通过不同的反应得到下列四种物质:
①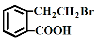 ②
② ③
③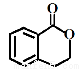 ④
④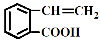
生成这四种有机物的反应类型依次为
A.酯化、取代、缩聚、取代 B.取代、取代、加聚、消去
C.取代、缩聚、酯化、消去 D.取代、加成、酯化、消去
查看答案和解析>>
科目:高中化学 来源:2015届江苏省无锡江阴市高二下学期期中考试化学试卷(解析版) 题型:选择题
2013年6月11日我国成功发射了“神州十号”。这标志着中国人的太空时代又前进了一大步。发射“神十”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。已知:
N2(g)+2O2(g)=2NO2(g);△H=+67.7 kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534 kJ/mol
下列关于肼和NO2反应的热化学方程式中,正确的是
A.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l);△H=-1135.7 kJ/mol
B.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1000.3 kJ/mol
C.N2H4(g)+NO2(g)=3/2N2(g)+2H2O(l);△H=-1135.7 kJ/mol
D.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1135.7 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2015届江苏省无锡江阴市高二下学期期中考试化学试卷(解析版) 题型:选择题
下列热化学方程式正确的是
A.S(s)+O2(g)= SO2(g);ΔH= -269.8kJ/mol
B.NaOH (aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=+57.3kJ/mol
C.表示乙醇的燃烧热:C2H5OH(l)+3O2(g)=2CO2(g)+ 3H2O(g);ΔH=-1367.0 kJ/mol
D.2NO2 = O2+2NO;ΔH= +116.2kJ/mol
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高二下学期4月阶段测试化学试卷(解析版) 题型:填空题
25℃时,某酸HA:Ka=1.0×10-7,已知:溶液的酸度AG=lg[c(H+)/c(OH-)]
(1)HA的电离方程式为 。
(2)0.1 mol·L-1HA溶液中,c(H+)= ,AG= 。
(3)保持25℃,下列方法能使HA溶液的电离度、溶液pH都增大的是 (填字母)
A.加水稀释 B.加少量盐NaA固体 C.加少量NaOH固体
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高二下学期4月阶段测试化学试卷(解析版) 题型:选择题
室温下,对于0.10 mol·L-1的氨水,下列判断正确的是
A.与AlCl3溶液发生反应的离子方程式为Al3++3OH- Al(OH)3↓
Al(OH)3↓
B.其溶液的pH=13
C.用适量水稀释后,NH3·H2O电离度和溶液pH都增大
D.加水稀释后,溶液中c(NH4 +)·c(OH-)变小
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期摸底考试化学试卷(解析版) 题型:选择题
下列物质分类的正确组合是
分类 组合 | 纯净物 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
A | 碱石灰 | 乙二酸 | 纯碱 | 氧化铝 | 二氧化碳 |
B | 盐酸 | 石炭酸 | 小苏打 | 氧化镁 | 二氧化氮 |
C | H2O2 | 硬脂酸 | 苏打 | 过氧化钠 | 二氧化硫 |
D | 五水硫酸铜 | 油酸 | 碱式碳酸铜 | 氧化钠 | 三氧化硫 |
查看答案和解析>>
科目:高中化学 来源:2015届广西桂林市高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列实验误差分析错误的是
A、用润湿的pH试纸测稀碱溶液的pH,测定值偏小
B、用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C、滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D、测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com