
下列热化学方程式正确的是
A.S(s)+O2(g)= SO2(g);ΔH= -269.8kJ/mol
B.NaOH (aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=+57.3kJ/mol
C.表示乙醇的燃烧热:C2H5OH(l)+3O2(g)=2CO2(g)+ 3H2O(g);ΔH=-1367.0 kJ/mol
D.2NO2 = O2+2NO;ΔH= +116.2kJ/mol
科目:高中化学 来源:2015届江苏省苏州市高三9月学情调研化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.核内有8个中子的碳原子: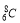 B.甲烷分子的比例模型:
B.甲烷分子的比例模型:
C.羟基的电子式: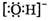 D.氯离子的结构示意图:
D.氯离子的结构示意图: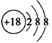
查看答案和解析>>
科目:高中化学 来源:2015届江苏省沭阳县高二下学期期中调研测试化学试卷(解析版) 题型:选择题
已知25℃、101kPa条件下:
4Al (s) + 3O2 (g)=2Al2O3 (s) △H=-2834.9 kJ/mol
4Al (s) + 2O3 (g) = 2Al2O3 (s) △H= -3119.91kJ/mol
由此得出的结论正确的是
A.等质量的O2比O3能量低,由O2变O3 为放热反应
B.等质量的O2比O3能量低,由O2变O3 为吸热反应
C.3O2(g)=2O3 (g) △H=285.0 kJ/mol
D.O3比O2稳定,由O2变O3 为吸热反应
查看答案和解析>>
科目:高中化学 来源:2015届江苏省无锡江阴市高二下学期期中考试化学试卷(解析版) 题型:填空题
(1)已知下列两个热化学方程式:
C3H8(g)+5O2(g) =3CO2(g)+4H2O(l) ΔH=-2220.0 kJ·mol-1
H2O(l)=H2O(g) ΔH=+44.0 kJ·mol-1
则0.5 mol丙烷燃烧生成CO2和气态水时释放的热量为 。
(2)已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式: 。
(3)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出 kJ能量。
N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出 kJ能量。

(4)阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池总反应为:2H2+O2=2H2O,电解质溶液为稀H2SO4溶液,电池放电时是将 能转化为 能。其电极反应式分别为:负极 ,正极 。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省无锡江阴市高二下学期期中考试化学试卷(解析版) 题型:选择题
将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.6 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.15mol·L-1·s-1
③2s时物质A的转化率为30%
④2s时物质B的浓度为0.3 mol·L-1
其中正确的是
A.①③ B.①④ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高二下学期4月阶段测试化学试卷(解析版) 题型:填空题
以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备二氧化氯气体,再用水吸收获得二氧化氯溶液。在此过程中需要控制适宜的温度, 若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2气体的吸收率。具体情况如图所示。请回答下列问题

(1)据图可知,反应时需要控制的适宜温度是 ℃,达到此要求采取的适宜措施是 。
(2)已知:黄铁矿中的硫元素在酸性条件下被ClO3-氧化成SO42-,写出制备二氧化氯的离子方程式: 。
(3)某校化学学习小组拟以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标。若取NaClO3样品质量6.0g,通过反应和吸收可得400 mL ClO2溶液,取出20 mL,加入37.00 mL 0.500 mol· (NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500 mol·
(NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500 mol· K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下:
K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下:
4H++ClO2+5Fe2+= +5Fe3+ +2H2O 14H+ +
+5Fe3+ +2H2O 14H+ + +6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O
+6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O
试计算ClO2的“产率”。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高二下学期4月阶段测试化学试卷(解析版) 题型:选择题
在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g) zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
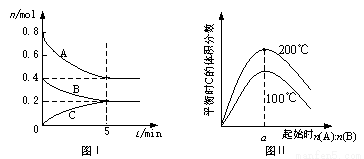
A.200℃时,反应从开始到平衡的平均速率v(B)= 0. 02 mol·L-1·min-1
B.图Ⅱ所知反应xA(g)+yB(g) zC(g)的△H<0,且a=2
zC(g)的△H<0,且a=2
C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于0.5
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期摸底考试化学试卷(解析版) 题型:填空题
(12分)铁在地壳中的含量约占 5 %左右。铁矿石的种类很多,重要的有磁铁矿石
(主要成分是Fe3O4)、赤铁矿石(主要成分是 Fe2O3)等。
(1)红热的铁能跟水蒸气反应,一种产物与磁铁矿的主要成分相同,另一种产物是
可燃性气体,则其反应的化学方程式为 。 该可燃气体在酸性
条件下,可制成燃料电池,写出该气体发生的电极反应式 。
(2)在常温下,铁跟水不起反应。但在潮湿的空气中,铁很容易生锈(铁锈的主要成分是 Fe203)而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。铁生锈的化学原理如下,请你用离子方程式和化学方程式补充完整。
① 原电池反应:
负极:2Fe-4e-=2Fe2+、正极: ;
② 氢氧化物的形成: Fe2 + + 2OH-= Fe(OH) 2↓ 。
③ 氢氧化物的分【解析】
2Fe(OH)3 =Fe2O3+3H2O。
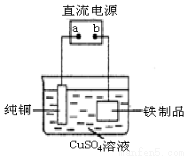
(3)为了防止铁生锈,可在铁制品表面镀上一层铜(如图装置),a为 (填“正极”或“负极”),
铁制品表面发生的电极反应式 为 。
查看答案和解析>>
科目:高中化学 来源:2015届广西桂林市高三上学期第一次月考化学试卷(解析版) 题型:实验题
(12分)某研究小组利用下图装置探究温度对CO还原Fe2O3的影响(固定装置略)
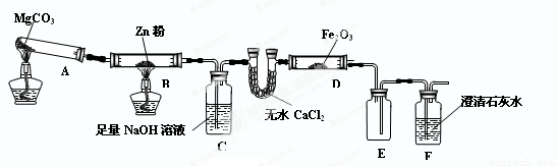
(1) MgCO3的分解产物为 。
(2) 装置C的作用是 ,处理尾气的方法为 。
(3) 将研究小组分为两组,按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯给装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 | 蓝色沉淀 |
3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
已知:3Fe2+ + 2[Fe(CN)6]3- = Fe3[Fe(CN)6]2↓(蓝色)
① 乙组得到的黑色粉末是 ;
② 甲组步骤1中反应的离子方程式为 ;
③ 乙组步骤4中,溶液变红的原因为 ;溶液褪色可能的原因及其验证方法为
;
④ 从实验安全考虑,上图装置还可采取的改进措施是 ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com