
| A、原子半径:X>Y>Z>W |
| B、原子序数:X>Y>Z>W |
| C、原子最外层电子数:Z>W>Y>X |
| D、最高价氧化物对应的水化物都具有酸性 |


科目:高中化学 来源: 题型:
| A、①② | B、①②③④ |
| C、①②④ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,其分子式为
,其分子式为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol/L的碳酸钠溶液中,Na+和CO32-离子个数比是2:1 |
| B、析氢腐蚀负极发生氧化反应析出氢气,吸氧腐蚀正极发生还原反应吸收氧气 |
| C、向KI溶液中滴加氯水,振荡,静置后能观察到液体会分层,下层呈紫色 |
| D、除去CO2中混有的少量SO2,可将混合气体通通盛有酸性KMnO4溶液的洗气瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应说明钠是强氧化剂,可用于冶炼金属 |
| B、该反应条件是TiCl4在熔融状态或水溶液中 |
| C、Ti是氧化产物 |
| D、若有1mol TiCl4参加反应,则转移的电子为4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀醋酸与氢氧化钠溶液的反应:H++OH-═H2O |
| B、铜粉与稀硝酸的反应:Cu+2H+═Cu2++H2↑ |
| C、氯气与碘化钾溶液的反应:Cl2+I-═Cl-+I2 |
| D、碳酸钠溶液与足量稀盐酸的反应:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
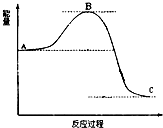 已知2SO2(g)+O2(g)
已知2SO2(g)+O2(g) | 加热 |
| 催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com