
| A、稀醋酸与氢氧化钠溶液的反应:H++OH-═H2O |
| B、铜粉与稀硝酸的反应:Cu+2H+═Cu2++H2↑ |
| C、氯气与碘化钾溶液的反应:Cl2+I-═Cl-+I2 |
| D、碳酸钠溶液与足量稀盐酸的反应:CO32-+2H+═H2O+CO2↑ |


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
| A、混合气体的压强 |
| B、混合气体的密度 |
| C、B的物质的量浓度 |
| D、气体总物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、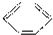 +HONO2 +HONO2
 +H2O +H2O | |||
B、CH3CH3OH+CH3COOH
| |||
C、CH3CH2OH
| |||
| D、BrCH=CHBr+Br2→CHBr2CHBr2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、②③ | C、①④ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:X>Y>Z>W |
| B、原子序数:X>Y>Z>W |
| C、原子最外层电子数:Z>W>Y>X |
| D、最高价氧化物对应的水化物都具有酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将40g NaOH溶于1L水所得的溶液 |
| B、将0.5mol?L-1的NaNO3溶液100mL加热蒸发掉50g水所得的溶液 |
| C、将23g Na溶于水并配成1L的溶液 |
| D、从1L 2mol/L的H2SO4溶液中取出0.5L,该溶液的浓度为1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
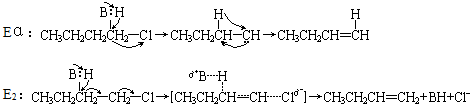
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com