
【题目】下列两种物质的溶液混合后,能发生离子反应,且溶液的总质量不会发生改变的是
A.石灰水和稀盐酸混合
B.小苏打溶液和柠檬水混合
C.人工盐(含有硫酸钠、碳酸氢钠、氯化钠、硫酸钾)溶液与BaCl2溶液混合
D.氯化钠溶液和蔗糖水混合
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】在T ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·cm-3,溶质的质量分数为w,其中含NH![]() 的物质的量为b mol。下列叙述中正确的是( )
的物质的量为b mol。下列叙述中正确的是( )
A.溶质的质量分数w=![]() ×100%
×100%
B.溶质的物质的量浓度c=![]() mol·L-1
mol·L-1
C.溶液中c(OH-)=![]() mol·L-1
mol·L-1
D.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大。元素A、B、C、D、E的原子结构等信息如下:
元素 | 元素性质或原子结构 |
A | 周期表中原子半径最小的元素 |
B | 原子核外有三种不同的能级且各个能级所填充的电子数相同 |
C | 最外层P轨道半充满 |
D | 位于短周期,其原子的核外成对电子数是未成对电子数的3倍 |
E | 位于ds区且原子的最外层电子数与A的相同 |
请回答下列问题:(用A、B、C、D、E所对应的元素符号作答)
(1)B、C、D第一电离能由大到小为______________________。
(2)E的二价离子的电子排布式为________________________。
(3)A2B2D4常用作除锈剂,该分子中B的杂化方式为________;1 mol A2B2D4分子中含有σ键数目为________。
(4)与化合物BD互为等电子体的阴离子化学式为________等。
(5)B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是_____________________。
(6)BD2在高温高压下所形成晶体的晶胞如图所示,一个该晶胞中含________个D原子。
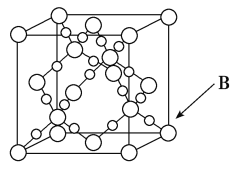
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100 mL 0.1 mol·L-1的醋酸溶液中,欲使醋酸的电离程度增大,H+浓度减小,可采用的方法是
A.加热 B.加入100 mL 0.1 mol·L-1的醋酸溶液
C.加入少量的0.5 mol·L-1的硫酸 D.加入少量的1 mol·L-1的NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们在日常生活中大量使用各种高分子材料,下列说法正确的是
A. 天然橡胶易溶于水 B. 羊毛是合成高分子材料
C. 聚乙烯塑料是天然高分子材料 D. 聚氯乙烯塑料会造成“白色污染”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.1mol SO42﹣的质量是96 g
B.1mol H2O的质量是18 g/mol
C.CO2的摩尔质量是44 g
D.HCl的相对分子质量是36.5 g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有K2SO4和Fe2(SO4)3的混合溶液,含Fe3+的物质的量浓度为0.1mol/L,而SO42﹣的物质的量浓度为0.3mol/L,则混合溶液中K+的物质的量浓度为( )
A.0.15mol/L B.0.3mol/L C.0.45mol/L D.0.6mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝可以制造多种建筑型材。铝在空气中能够稳定存在的原因是( )
A. 铝的活泼性很差 B. 铝的还原性很差
C. 铝与氧气不反应 D. 铝表面有致密的氧化膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度和压强下,1体积X2气体与3体积Y2气体化合生成2体积气体化合物,则该气体化合物的化学式为( )
A.X2Y3
B.XY3
C.XY
D.X3Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com