
| A、门捷列夫根据原子量排列的周期表成功预言了类铝(镓)、类硅(锗)等元素的存在 |
| B、铀(U)属于过渡元素,能跟氟形成UF6,据此可推测U原子最外层有6个电子 |
| C、HF、HCl、HBr、HI的还原性依次增强,热稳定性依次减弱,沸点依次升高 |
| D、Na、Mg、Al原子的最外层电子数依次增加,故失去电子的能力越来越强 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、某溶液中滴加AgNO3溶液有白色沉淀,说明原溶液中有Cl- |
| B、某溶液中先滴加足量盐酸无现象,再滴加BaCl2溶液有白色沉淀,则原溶液中有SO42- |
| C、某无色溶液滴入酚酞试液显红色,该溶液一定是含有大量的H+ |
| D、某溶液中滴加稀硫酸生成无色气体,说明原溶液中有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 25.02 | 24.22 | 24.18 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=1的溶液中:Na+、K+、MnO4-、CO32- |
| B、0.1 mol/L NH4HCO3溶液中:K+、Na+、NO3-、Cl- |
| C、c(Fe3+)=0.1 mol/L的溶液中:NH4+、Cl-、AlO2-、SO42- |
| D、室温下,水电离出的c(H+)=1×10-13mo1/L的溶液中:Mg2+、K+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
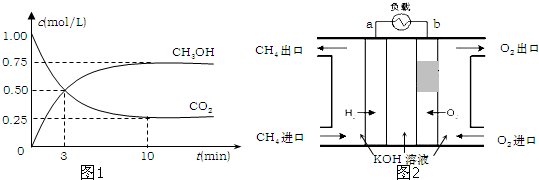
查看答案和解析>>
科目:高中化学 来源: 题型:
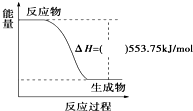 2010年广州亚运会主火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:
2010年广州亚运会主火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制一定物质的量浓度的溶液,定容时俯视刻度线会导致所配溶液浓度偏小 |
| B、需要95 mL 0.1 mol?L-1NaCl溶液,可选用100 mL容量瓶来配制 |
| C、用100 mL的量筒量取5.2 mL的盐酸 |
| D、用托盘天平称取25.20 g NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C6H12N4 |
| B、C4H8N4 |
| C、C6H10N4 |
| D、C6H8N4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| A、-317.3 kJ/mol |
| B、-379.3 kJ/mol |
| C、-332.8 kJ/mol |
| D、+317.3 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com