
常温下,将 pH=3 的硫酸与 pH=9 的 NaOH 溶液混合,若要得到 pH = 7 的溶液,混合时硫酸与 NaOH 溶液的体积比为( )
A.1: 200 B. 200 : 1 C. 100 : 1 D.1:100
 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源:2016-2017学年浙江省湖州市高二上期中化学试卷(解析版) 题型:填空题
甲醇是21世纪应用最广泛的清洁燃料之一,通过以下反应可以制备甲醇:
CO(g)+2H2(g)=CH3OH(l) △H=?
(1)已知:2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1
2CO(g)+O2(g)=2C O2(g) △H=-566.0kJ·mol-1
O2(g) △H=-566.0kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1453.0kJ·mol-1
则制备甲醇反应的△H = kJ·mol-1
(2)若装置为容积固定的密闭容器,不同时间段各物质的浓度如下表:
c(CO) /mol·L-1 | c(H2) /mol·L-1 | c(CH3OH) /mol·L-1 | |
0min | 0.8 | 1.6 | 0 |
2min | 0.6 | y | 0.2 |
4min | 0.3 | 0.6 | 0.5 |
6min | 0.3 | 0.6 | 0.5 |
反应从2min到4min之间,H2的平均反应速率为________ mol·Lˉ1·minˉ1。
反应在第2min时改变了反应条件,改变的条件可能是 (填字母序号)。
A.使用催化剂 B.降低温度 C.增加H2的浓度 D.减小CH3OH(g)的浓度
(3)若在容积可变的密闭容器中充入1 mol CO(g)和2 molH2 (g)生成CH3OH(g),H2的平衡转化率随温度(T)、压强(P)的变化如图所示。当达到平衡状态A 时,容器的体积为2 L,此时该反应的平衡常数为 ,若达到平衡状态B 时,则容器的体积V(B)= L。

(4)一定温度下,在容积固定的密闭容器中充入一定量的H2和CO,在t1时达到平衡。t2时将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时达到新的平衡状态,之后不再改变条件。请在右图中补画出从t2到t4正反应速率随时间的变化曲线。

查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省慈溪市高二上学期期中化学试卷(解析版) 题型:选择题
在一定的条件下,将 2mol SO2和1mol O2充入一定容密闭容器中,发生下列反应:2SO2(g)+O2(g)  2SO3(g) △H=-197 kJ/mol, 当达到平衡状态时,下列说法中正确是( )
2SO3(g) △H=-197 kJ/mol, 当达到平衡状态时,下列说法中正确是( )
A.生成 2 mol SO3 B.放出热量197 kJ
C.SO2 和 SO3 共有 2 mol D.含有氧原子共有3mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:选择题
下列条件下,对应离子一定能大量共存的是
A.在0.1mol/LNa2CO3 溶液中:Al3+、NH4+、SO42-、NO3-
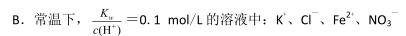
C.使甲基橙变红的溶液中:NH4+、Cl-、SO42-、Mg2+
D.25℃时,水电离出的 c(H+)=1×l0-l3 mol/L 的溶液中:K+、Ba2+、NO3-、S2-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:选择题
已知化学反应 A2(g)+B2(g)=2AB(g)的能量变化如图所示,下列叙述中正确的是( )
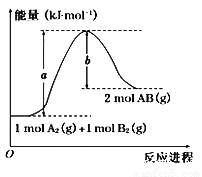
A.每生成 2 分子 AB 吸收 b kJ 热量
B.该反应热 ΔH=+(a-b)kJ/mol
C.该反应中反应物的总能量高于生成物的总能量
D.断裂 1 mol A—A 和 1 mol B—B 键,放出 a kJ 能量
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二上期中化学试卷(解析版) 题型:填空题
已知可逆反应CO(g)+H2O(g) CO2(g)+H2(g),达到平衡时。
CO2(g)+H2(g),达到平衡时。
(1)830K时,若起始时:c(CO)=2mol/L,c(H2O)=3mol/L,平衡时CO的转化率为60%,水蒸气的转化率为____________;K值为_________。
(2)830K,若只将起始时c(H2O)改为6mol/L,其他条件不变,则水蒸气的转化率为____________。
(3)若830K时,起始浓度c(CO)=a mol/L,c(H2O)=b mol/L,H2的平衡浓度c(H2)=c mol/L,a、b、c之间的关系式是___________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二上期中化学试卷(解析版) 题型:选择题
已知2H(g)+Y(g)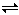 2I(g)反应,在t℃时,在一压强恒定的密闭容器中,加入4 mol H和2 mol Y反应,达到平衡后,Y剩余0.2 mol。若在上面的平衡体系中,再加入1 mol气态的I物质,t ℃时达到新的平衡,此时H物质的物质的量n(H)为( )
2I(g)反应,在t℃时,在一压强恒定的密闭容器中,加入4 mol H和2 mol Y反应,达到平衡后,Y剩余0.2 mol。若在上面的平衡体系中,再加入1 mol气态的I物质,t ℃时达到新的平衡,此时H物质的物质的量n(H)为( )
A.0.2mol B.0.5 mol C.0.6 mol D.0.8 mol
查看答案和解析>>
科目:高中化学 来源:2017届四川省成都市高三上学期一诊化学试卷(解析版) 题型:填空题
钛矿工业中的酸性废水富含Ti、Fe等元素,其综合利用如下:
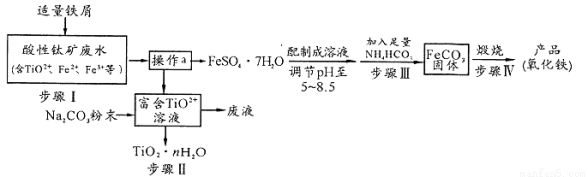
已知:TiO2+易水解,只能存在于强酸性溶液中。
(1)TiO2+钛的化合价为
(2)步骤I中检验钛矿废水中加入铁屑是否足量的试剂是 。
(3)操作a是蒸发浓缩、冷却结晶、 。
(4)步骤Ⅲ中发生反应的化学方程式为____________;反应温度一般需控制在35℃以下,其目的是 。
(5)已知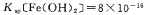 s。步骤Ⅲ中,FeCO3达到溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6 mol/L。试判断所得的FeCO3中________(填“有”或“没有”)Fe(OH)2;步骤Ⅳ中,为了得到较为纯净的Fe2O3,除了适当的温度外,还需要采取的措施是 。
s。步骤Ⅲ中,FeCO3达到溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6 mol/L。试判断所得的FeCO3中________(填“有”或“没有”)Fe(OH)2;步骤Ⅳ中,为了得到较为纯净的Fe2O3,除了适当的温度外,还需要采取的措施是 。
(6)向“富含TiO2+溶液”中加入Na2CO3粉末得到固体TiO2·nH2O。请结合原理和化学用语解释其原因 。
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省铁岭市协作体高三上联考四化学试卷(解析版) 题型:填空题
元素铬及其化合物工业用途广泛,但含+6价铬的污水会损害环境。电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-,处理该废水常用直接沉淀法、还原沉淀法、电解法。
I.直接沉淀法
(1)已知含铬废水中存在着平衡: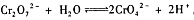 。在实际工业生产中,加入沉淀剂BaCl
。在实际工业生产中,加入沉淀剂BaCl 2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成沉淀的化学式为
2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成沉淀的化学式为
Ⅱ.还原沉淀法
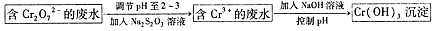
(2)下列溶液中可以代替上述流程中Na2S2O3溶液的是 (填选项序号)
A.FeSO4溶液 B.浓H2SO4溶液
C.酸性KMnO4溶液 D.Na2SO3溶液
(3)上述流程中,每消耗0.1molNa2S2O3转移0.8mole-,则加入Na2S2O3溶液时发送反应的离子方程式为
(4)Cr(OH)3的化学性质与Al(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,原因可用离子方程式表示:
(5)实际工业生产中有时还采用阳离子交换树脂法来测定沉淀后溶液中Cr3+的含量,其原理是Mn++nNaR=nNa++MRn,其中NaR为阳离子交换树脂,Mn+为要测定的离子。
常温下,某次测定过程中,将pH=5的废水经过阳离子交换树脂后,测的溶液中Na+比交换前增加了4.6×10-2g/L,则该条件下Cr(OH)3的Ksp的值为 ,当Cr3+浓度小于10-5mol/L时可认为沉淀完全,处理后测得溶液的PH=6,则溶液过滤后 (填“能”或“否”)直接排放
Ⅲ.电解法
(6)该法是用铁作电极点解含Cr2O72-的酸性废水,电解时阴极上有大量气泡生成,并产生Cr(OH)3、Fe(OH)3沉淀,反应中1mol Cr2O72-完全生成Cr(OH)3沉淀,外电路 通过的电子的物质的量为 mol
通过的电子的物质的量为 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com