
| A. | H2O | B. | NH3 | C. | PH3 | D. | CH4 |
分析 中心原子的杂化类型为sp3,说明该分子中心原子的价层电子对个数是4,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$×(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数,同类型的杂化轨道可分为和不两种,如果原子轨道杂化后形成的杂化轨道是等同的,这种杂化叫做等性杂化.,有孤对电子的存在的杂化为不等性杂化,据此判断.
解答 解:A.H2O中价层电子对个数=σ键个数+孤电子对个数=2+$\frac{1}{2}$×(6-2×1)=4,所以O原子采用sp3杂化,有孤对电子的存在,杂化后的四个轨道不完全相同,故A错误;
B.氨气分子中氮原子价层电子对个数=3+$\frac{1}{2}$×(5-3×1)=4,所以N原子采用sp3杂化,有孤对电子的存在,杂化后的四个轨道不完全相同,故B错误;
C.PH3中P原子形成3个σ键,孤电子对个数=$\frac{1}{2}$×(5-3×1)=1,价层电子对数为4,为sp3杂化,有孤对电子的存在,杂化后的四个轨道不完全相同,故C错误;
D.CH4中C原子形成4个δ键,孤电子对个数为0,价层电子对数为4,为sp3杂化,无孤对电子的存在,中心原子采用sp3等性杂化,故D正确;
故选D.
点评 本题考查了原子杂化方式的判断,根据价层电子对互斥理论来分析解答即可,明确孤电子对个数=$\frac{1}{2}$(a-xb)中各个字母的含义,注意根据孤对电子的存在判断是否为等性杂化,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 对农作物秸秆进行焚烧还田,以增加土壤肥力 | |
| B. | 推广使用无磷洗衣粉,以减少水体富营养化 | |
| C. | 改进汽车尾气净化技术,减少大气污染物的排放 | |
| D. | 研发可降解高分子材料,减少“白色污染” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | C-C | C═C | C≡C | C-H | H-H | Cl-Cl | H-Cl |
| 键焓(△H)/kJ•mol-1 | 347.7 | 615.0 | 812.0 | 413.4 | 436.0 | 242.7 | 431 |
| A. | CH2═CH2(g)+H2(g)→CH3CH3(g)△H=+123.5 kJ•mol-1 | |
| B. | CH≡CH(g)+2H2(g)→CH3CH3(g)△H=-317.3 kJ•mol-1 | |
| C. | 稳定性:H-H键<H-Cl键<C-H键 | |
| D. | 由上表数据可计算乙烷与氯气发生一氯代反应的焓变(△H) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13.6g | B. | 12g | C. | 6g | D. | 3.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 己烷(己烯) | 溴水 | 分液 |
| B | 淀粉溶液(NaCl) | 水 | 过滤 |
| C | 苯(苯酚) | NaOH溶液 | 分液 |
| D | 甲烷(乙烯) | KMnO4酸性溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
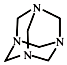
| A. | 化学式为C6H12N4,属于饱和烃 | |
| B. | 不能发生加成反应,一氯取代产物有3种 | |
| C. | 分子中既含极性共价键又含非极性共价键 | |
| D. | 可由甲醛(HCHO)与氨气按物质的量之比3:2完全反应制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
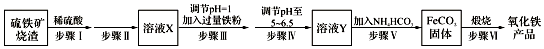
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
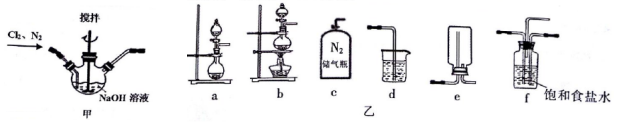
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com