
| n |
| V |
| △c |
| △t |
| 消耗量 |
| 起始量 |
| 2.4mol-1.2mol |
| 2L |
| ||
| 3min |
| 0.6mol |
| 2.4mol |
| 0.6mol |
| 1.2mol+1.8mol+0.6mol+1.2mol |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
18 8 |
16 8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| Mg的质量 | 酸量 | 开始的反应速率 | 产生 H2总量 | |
| Ⅰ | 0.24g | HC1 0.2mol/L100mL | v1 | n1 |
| Ⅱ | 0.24g | CH3COOH 0.2mol/L100mL | v2 | n2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
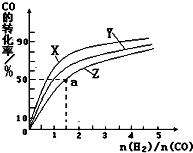 欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫.请运用化学反应原理的相关知识研究碳及其化合物的性质.
欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫.请运用化学反应原理的相关知识研究碳及其化合物的性质.| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
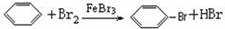
查看答案和解析>>
科目:高中化学 来源: 题型:
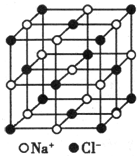 纳米材料的表面粒子数占总粒子数的比例极大,这是它具有许多特殊性质的原因.假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状(如图所示)相同.则这种纳米颗粒的表面粒子数占总粒子数的百分数为( )
纳米材料的表面粒子数占总粒子数的比例极大,这是它具有许多特殊性质的原因.假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状(如图所示)相同.则这种纳米颗粒的表面粒子数占总粒子数的百分数为( )| A、87.5% | B、92.9% |
| C、96.3% | D、100% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com