
【题目】用Pt极电解含有Ag+、Cu2+和X3+各0.1 mol的溶液,阴极析出固体物质的质量m (g)与回路中通过电子的物质的量n (mol)关系如图所示。则下列氧化性强弱的判断正确的是

A. Ag+>X3+>Cu2+>H+>X2+
B. Ag+>Cu2+>X3+>H+>X2+
C. Cu2+>X3十>Ag十>X2+>H+
D. Cu2+>Ag+>X3+>H+>X2+
科目:高中化学 来源: 题型:
【题目】I、白藜芦醇的结构简式如下图。它广泛存在于食物(如桑椹、花生,尤其是葡萄)中,可能具有抗癌性。下列有关白藜芦醇的说法正确的是
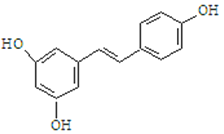
A.该有机物属于醇类
B.1mol该有机物与H2加成时最多消耗1mol H2
C.1mol该有机物与Br2反应时最多消耗6mol Br2
D.1mol该有机物最多消耗3mol NaOH
Ⅱ、根据下列的有机物合成路线回答问题:

(1)写出A、B的结构简式:A 、B 。
(2)写出各步反应类型:
① 、② 、③ 。
(3)写出②、③的反应方程式:
②
③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A→F有如下转化关系:

已知:①
②核磁共振氢谱显示C的分子中含有4种不同化学环境的氢原子,且峰面积之比为3:2:2:1。
③F是酯类化合物,分子中苯环上的一溴代物只有两种。
(1)A的分子式是 ,主要用途是 (写一种)。
(2)检验B中官能团的常用方法是 。
(3)D物质的名称为 。
(4)C+E→F的化学方程式是 。
(5)X与E互为同分异构体,且X有下列性质,符合条件的X有 种。
①接触NaHCO3有二氧化碳气体产生。
②与银氨溶液共热有银镜现象。
③1摩尔X与足量钠反应有1摩尔气体产生。
(6)Y与E也互为同分异构体,属于酯类化合物,分子中只含一种官能团,且苯环上的一硝基取代物只有一种,则Y的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用新方案和新工艺处理废旧铅酸蓄电池,可以达到节能减排、防治污染和资源循环利用的目的。一种处理铅酸蓄电池的流程如下:

已知。Ksp(PbSO4)=1.6×10 -8) 和Ksp(PbCO3)=1.4×10-14
(1)写出铅酸蓄电池放电时的总反应: __________。
(2)废旧电池的预处理时需要将电池放电完全,目的是__________。
(3)写出铅膏脱硫时的离子方程式__________。
(4)传统的铅蓄电池的处理工艺是将电池破碎后,洗涤,干燥,直接送入回转炉熔炼。而该工艺使用纯碱脱硫的显著优点是__________。
(5)已知芒硝(Na2SO4·10H2O)的溶解度曲线如下图所示,则从Na2SO4溶液中结晶出Na2SO4晶体的方法是加热结晶、__________、用乙醇洗涤晶体。用乙醇不用水洗涤的原因是__________。

(6)应用电化学原理,将铅膏转化为铅可以非常清洁处理蓄电池,其原理是先用细菌将铅膏转换为PbS,再用氟硼酸铁浸出PbS,化学方程式为:
PbS+2Fe[BF4]3=Pb[BF4]2+2Fe[BF4]2+S
最后通过电解浸出液得到金属铅,电解后的溶液可以循环使用,写出电解的总反应方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫以及铁的化合物。
Ⅰ.近年来,湿法炼铜有了新进展,某工厂以一种叫Thibacillus ferroxidans的细菌为基体生产铜和绿矾的工艺流程如下:

(1)试剂a为________,试剂b为_______(写名称)。
(2)反应1的化学方程式为 。
Ⅱ.以CuFeS2精矿为原料在沸腾炉中和O2(空气)反应,生成物冷却后经溶解、除铁、结晶,得到CuSO4·5H2O。沸腾炉的温度与生成物主要成分的水溶性和酸溶性实验结果如图。

(3)沸腾炉生成物中的含铁物质主要成分为___________。
(4)为获得最高的水溶性Cu(%),沸腾炉的温度应控制在______ ℃左右,高于该温度生成物中的水溶性Cu(%)下降,可能原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有X、Y、Z三种元素,已知有如下情况:
①X、Y、Z的单质在常温下均为气体。
② X的单质在Z的单质中燃烧,生成XZ,燃烧时火焰呈苍白色。
③ XZ极易溶于水,在水溶液中电离出X+和Z-。XZ的水溶液可使石蕊试液变红。
④两分子X的单质可与一分子Y的单质化合生成两分子X2Y,X2Y常温下为液体。
⑤ Z的单质溶于X2Y中,所得溶液具有漂白作用。
请完成下列问题:
(1)写出XZ和X2Y的化学式:XZ X2Y
(2)Z的单质溶于X2Y后,溶液起漂白作用的物质是 (写化学式)。
(3)写出实验室制取X的单质的离子方程式 _______________。
(4)Z的单质能否与氢氧化钠溶液发生反应: (填“能”或“否”),若能,请写出反应的离子方程式: _______________。
(若不能反应,则此空不必填写)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,其中的编号代表所对应的元素。请回答下列问题:

(1)⑧号元素的基态原子的价电子排布式是_________________,与其同周期,且基态原子的核外未成对电子数最多的元素是_______________(写出元素符号)。
(2)④号与⑦号元素形成的氧化物的熔点由高到低的是_________________。
(3)①号与③号元素形成的含有18电子的分子为___________(写出名称),该分子中③元素的原子的杂化方式为______________。②、④、⑧三种元素的原子形成的晶体,其晶胞的结构特点如图所示,则该化合物的化学式为______________(用对应的元素符号表示)。

(4)下表是某些短周期元素的电负性值:
元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
X值 | 1.0 | 1.5 | 2.0 | 2.5 | 3.5 | 4.0 | 0.9 | 1.5 | 1.8 | 2.58 | 2.5 | 3.1 |
①通过分析电负性值变化规律,确定N最接近的电负性值范围:________<N<__________
②推测电负性值与原子半径关系是____________________;
③试判断:AlBr3中化学键类型是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】硼和氮元素在化学中有很重要的地位,回答下列问题:
(1)基态硼原子核外电子有____ ____种不同的运动状态,基态氮原子的价层电子排布图为_________________。预计于2017年发射的“嫦娥五号”探测器采用的长征5号运载火箭燃料为偏二甲肼[(CH3)2NNH2]。(CH3)2NNH2中N原子的杂化方式为_________。
(2)化合物H3BNH3是一种潜在的储氢材料,可利用化合物B3N3H6通过如下反应制得:3CH4+2B3N3H6+ 6H2O=3CO2+6H3BNH3
①H3BNH3分子中是否存在配位键_______________(填“是”或“否”),B、C、N、O的第一电离能由小到大的顺序为___________________。
②与B3N3H6互为等电子体的分子是_____________(填一个即可),B3N3H6为非极性分子,根据等电子原理写出B3N3H6的结构式____________________________。
(3)“嫦娥五号”探测器采用太阳能电池板提供能量,在太阳能电池板材料中除单晶硅外,还有铜,铟,镓,硒等化学物质,回答下列问题:
①SeO3分子的立体构型为_____________。
②金属铜投入氨水或H2O2溶液中均无明显现象,但投入氨水与H2O2的混合溶液中,则铜片溶解,溶液呈深蓝色,写出该反应的离子反应方程式为 。

③某种铜合金的晶胞结构如图所示,该晶胞中距离最近的铜原子和氮原子间的距离为![]() pm,则该晶体的密度为_________________(用含a的代数式表示,设NA为阿
pm,则该晶体的密度为_________________(用含a的代数式表示,设NA为阿
伏伽德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。已知高铁酸盐热稳定性差,高铁酸盐在碱性环境中比酸性环境中相对稳定。工业上用湿法制备高铁酸钾的基本流程如下图所示:

下列有关说法不正确的是
A.控制反应温度30℃以下的原因是防止生成的K2FeO4发生分解
B.结晶过程中加入浓KOH溶液其作用是增大K+浓度,促进K2FeO4晶体析出
C.滤液2中阳离子可通过焰色反应检验确定
D.湿法制备高铁酸钾,也可以在Fe(OH)3料浆中直接通入足量氯气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com