
 高温裂解法处理工业废硫酸的原理为:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g)△H=+550kJ/mol,它由两步反应组成:
高温裂解法处理工业废硫酸的原理为:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g)△H=+550kJ/mol,它由两步反应组成:分析 (1)已知:①2H2SO4(l)═2SO2(g)+O2(g)+2H2O(g)△H=+550kJ•mol-1
②H2SO4(l)═SO3(g)+H2O(g)△H=+177kJ•mol-1
根据盖斯定律①-2×②可得;
(2)根据化合价分析用Na2S2O3制备SO2,另一产物为S;
(3)反应气体体积增多,△S>0;
(4)已知:①SO2+V2O5?SO3+V2O4 K1,
②$\frac{1}{2}$O2+V2O4?V2O5 K2,则-(①+②)×2可得2SO3(g)?2SO2(g)+O2(g),再得该反应的K;
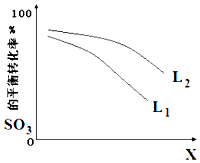
(5))①由图可知,X越大,转化率越低;
②分解反应为吸热反应,温度高,转化率大;
(6)根据三段式列出平衡时各物质的量计算.
解答 解:(1)已知:①2H2SO4(l)═2SO2(g)+O2(g)+2H2O(g)△H=+550kJ•mol-1
②H2SO4(l)═SO3(g)+H2O(g)△H=+177kJ•mol-1
根据盖斯定律①-2×②可得:2SO3(g)=2SO2(g)+O2(g)△H=+196 kJ/mol;
故答案为:2SO3(g)=2SO2(g)+O2(g)△H=+196 kJ/mol;
(2)Na2S2O3溶液中滴加稀硫酸制备二氧化硫的方程为:S2O3 2-+2H+=S↓+SO2↑+H2O;
故答案为:S2O3 2-+2H+=S↓+SO2↑+H2O;
(3)反应气体体积增多,△S>0;
故答案为:>;
(4)已知::①SO2+V2O5?SO3+V2O4 K1,
$\frac{1}{2}$O2+V2O4?V2O5 K2,
则-(①+②)×2可得2SO3(g)?2SO2(g)+O2(g),K=$\frac{1}{{{K}_{1}}^{2}•{{K}_{2}}^{2}}$;
故答案为:$\frac{1}{{{K}_{1}}^{2}•{{K}_{2}}^{2}}$;
(5)①)①由图可知,X越大,转化率越低,升高温度转化率增大,则X表示压强;
故答案为:压强;
②由SO3(g)=SO2(g)+O2(g)△H>0,温度高,转化率大,图中等压强时L2对应的转化率大;
故答案为:L2>L1;
(6)在T℃时,物质的量为9mol、体积为2L的SO3(g)发生反应,SO3的平衡转化率25%,
2SO3(g)?2SO2(g)+O2(g),
起始量(mol):9 0 0
转化量(mol):2.25 2.25 1.125
平衡量(mol):6.75 2.25 1.125
维持体系总压p恒定,平衡时容器的体积为V,则$\frac{9}{6.75+2.25+1.125}=\frac{2L}{V}$,V=2.25L,则平衡常数K=$\frac{(2.25mol÷2.25L)^{2}×(1.125mol÷2.25L)}{(6.75mol÷2.25L)^{2}}$=$\frac{1}{18}$mol/L;
故答案为:$\frac{1}{18}$ mol/L.
点评 本题考查盖斯定律、氧化还原反应、及化学平衡等,为高频考点,把握发生的反应、平衡影响因素为解答的关键,侧重分析与应用能力的综合考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
| n(X) | n(Y) | n(Z) | n(Y) | ||
| ① | 600 | 1 | 0 | 0 | 0.8 |
| ② | 600 | 0.1 | a | 0.9 | 0.8 |
| ③ | 600 | 0 | 1.5 | 1.5 | b |
| ④ | 500 | 0.5 | 1.2 | 1.0 | c |
| A. | 实验②起始时V(逆)<v(正)且a=0.9 | |
| B. | 600℃时,该反应平衡常数K=3.2 moI/L | |
| C. | 实验③中b<1.2 | |
| D. | 若b>c,则△H<O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 请回答下列问题:
请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂是人体不可缺少的营养物质 | |
| B. | 油脂的水解产物是氨基酸 | |
| C. | 油脂主要在小肠中被消化吸收 | |
| D. | 脂肪中多不饱和酸含量越高,其营养价值也越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com