
分析 (1)碳酸钙和盐酸反应生成氯化钙和二氧化碳;
(2)氢氧化钡溶液和稀硫酸反应生成硫酸钡和水;
(3)Fe2(SO4)3为强电解质完全电离;
(4)H++OH-=H2O可表示强酸与强碱反应生成可溶性盐和水.
解答 解:(1)碳酸钙和盐酸反应生成氯化钙和二氧化碳,离子方程式:CaCO3+2H+=Ca2++CO2↑+H2O;
故答案为:CaCO3+2H+=Ca2++CO2↑+H2O;
(2)氢氧化钡溶液和稀硫酸反应生成硫酸钡和水,离子方程式:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,
故答案为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;
(3)硫酸铁是强电解质完全电离;电离方程式为:Fe2(SO4)3=2Fe3++3SO42-,
故答案为:Fe2(SO4)3=2Fe3++3SO42-;
(4)符合离子方程式H++OH-=H2O的反应是强碱强酸稀溶液发生的中和反应生成水和溶于水的盐;化学方程式为:NaOH+HCl=NaCl+H2O,
故答案为:NaOH+HCl=NaCl+H2O.
点评 本题考查了离子方程式的书写,明确反应实质,熟悉离子方程式书写方法是解题关键,注意化学式拆分,注意离子反应遵循客观事实,题目难度不大.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 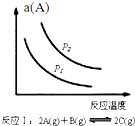 如图反应:△H<0,P2>P1 | |
| B. |  如图反应:△H<0,T1>T2 | |
| C. |  如图反应:△H>0,T2>T1 | |
| D. |  如图反应:△H>0,T2>T1或△H<0,T2<T1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 高温裂解法处理工业废硫酸的原理为:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g)△H=+550kJ/mol,它由两步反应组成:
高温裂解法处理工业废硫酸的原理为:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g)△H=+550kJ/mol,它由两步反应组成:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO4-和NO3-可能来自同一工厂 | B. | Cl-和NO3-一定来自不同的工厂 | ||
| C. | Ag+和Na+可能来自同一工厂 | D. | Na+和NO3-来自同一工厂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 类别组合 | 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 盐 |
| A | CO | CuO | H2SO4 | NH3•H2O | Na2S |
| B | CO2 | Na2O | HCl | NaOH | NaCl |
| C | SO2 | Na2O2 | CH3COOH | KOH | CaF2 |
| D | NO2 | CaO | HNO3 | Cu(OH)2CO3 | CaCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1=2Q2=92.4 | B. | Ql>2Q2 | C. | Q1<2Q2 | D. | Q1=2Q2>92.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 已知:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-Q1kJ/mol,则2H2O(l)=2H2(g)+O2(g)△H=-2Q1kJ/mol | |
| C. | 已知1 g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05 kJ的热量,其热化学方程式为 N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.6 kJ•mol-1 | |
| D. | 已知:强酸和强碱的稀溶液中和热可表示为:H+(aq)+OH-(aq)?H2O(l) △H=-57.3kJ/mol,则H2SO4(aq)+Ba(OH)2(aq)=BaSO4(aq)+2H2O(l)△H=-114.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠的晶体不能导电的原因是氯化钠晶体中不含阴、阳离子 | |
| B. | 在电流作用下氯化镁在水溶液中电离成镁离子和氯离子,表示为MgCl2=Mg2++2Cl- | |
| C. | NH4NO3电离时产生了NH4+、NO3-,无金属离子,所以NH4NO3不是盐 | |
| D. | 金属铜能够导电,但不属于电解质也不属于非电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com