
分析 (1)1mol纯净物完全燃烧生成稳定的氧化物所放出的热量为燃烧热;
(2)依据两个热化学方程式结合题干数据列式计算得到;
(3)根据氢气物质的量以及燃烧热、丙烷物质的量以及燃烧热,列式求出混合气体完全燃烧释放的热量;
(4)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减,反应热也处于相应的系数进行相应的加减,构造目标热化学方程式
解答 解:(1)已知下列两个热化学方程式:
H2(g)+$\frac{1}{2}$O2(g)═H2O(l);△H=-285.8KJ/mol,
C3H8(g)+5O2(g)═3CO2(g)+4H2O(l);△H=-2220.0KJ/mol,
则H2的燃烧热为285.8KJ/mol,C3H8的燃烧热为
故答案为:285.8KJ/mol;2220.0KJ/mol;
(2)H2和C3H8的混合气体共5mol,设氢气物质的量为x,丙烷物质的量为(5-x),完全燃烧生成液态水时放热6262.5kJ
H2(g)+$\frac{1}{2}$O2(g)═H2O(1)△H=-285.8kJ/mol
1mol 285.8kJ
xmol 285.8xkJ
C3H8(g)+5O2(g)═3CO2(g)+4H2O(1)△H=-2220.0kJ•mol-1
1mol 2220.0kJ
(5-x)mol 2220.0(5-x)kJ
285.8xkJ+2220.0×(5-x)kJ=6264.5kJ
解得:x=2.5mol;
混合气体中H2和C3H8的体积比=2.5:2.5=1:1;
故答案为:1:1;
(3)1molH2和2molC3H8组成的混合气体完全燃烧释放的热量为1mol×285.8kJ•mol-1+2mol×2220kJ•mol-1=4725.8kJ,
故答案为:4725.8kJ;
(4)已知:①C3H8(g)+5O2(g)═3CO2(g)+4H2O(1)△H=-2220.0kJ/mol
②H2O(1)=H2O(g)△H=+44.0kJ/mol
由盖斯定律可知,①+②×4得C3H8(g)+5O2(g)═3CO2(g)+4H2O(g)△H=-2044kJ/mol.
故答案为:C3H8(g)+5O2(g)═3CO2(g)+4H2O(g)△H=-2044kJ/mol.
点评 本题考查了热化学方程式书写和盖斯定律计算应用、化学反应热的有关计算分析、燃烧热概念分析应用,题目难度中等,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:实验题
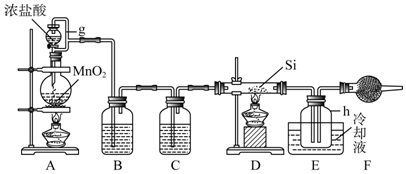
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl3 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -17.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 163 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
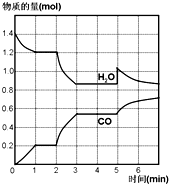 在一容积为2L的密闭容器中,高温下发生下列反应:C(s)+H2O(g)?CO(g)+H2(g),其中H2O、CO的物质的量(mol)随时间(min)的变化曲线如图所示:
在一容积为2L的密闭容器中,高温下发生下列反应:C(s)+H2O(g)?CO(g)+H2(g),其中H2O、CO的物质的量(mol)随时间(min)的变化曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
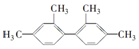 的烃,下列说法中正确的是( )
的烃,下列说法中正确的是( )| A. | 分子中至少有9个碳原子处于同一平面上 | |
| B. | 分子中至少有16个碳原子处于同一平面上 | |
| C. | 分子中至少有10个碳原子处于同一平面上 | |
| D. | 该烃不属苯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐水克导电,所以食盐水是电解质 | |
| B. | NH3的水溶液能够导电,所以NH3电解质 | |
| C. | 蔗糖溶于水不导电,所以蔗糖是非电解质 | |
| D. | BaSO4投入水中,导电性极弱,所以BaSO4是弱电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com