
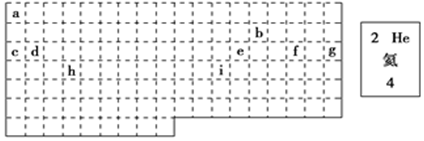
分析 (1)上边界为短周期元素,一周期有2种元素,二、三周期有8种元素,以此分析;
(2)长周期为四、五、六、七周期;为Ar,原子序数为18;i为Zn,原子序数为30.
解答 解:(1)上边界为短周期元素,一周期有2种元素,二、三周期有8种元素,表示元素周期表的部分边界如图: ,
,
故答案为: ;
;
(2)长周期为四、五、六、七周期,由图可知,a为H、b为C、c为Na、d为Mg、e为Al、f为S、g为Ar为短周期元素,共7种,H、C、Na、Mg、Al、S为主族元素,共6种,g为Ar,原子序数为18,位于第三周期零族;i为Zn,原子序数为30,位于第四周期IIB族,
故答案为:7;6;三;零;四;IIB.
点评 本题考查元素周期表的结构与应用,为高频考点,把握周期表的结构及边界、元素的位置为解答的关键,注重基础知识的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 硅酸盐可用于制作光导纤维 | |
| B. | FeCl3溶液能与Cu反应,可用于蚀刻印刷电路 | |
| C. | 明矾溶于水后会产生Al(OH)3胶体,可作为净水剂 | |
| D. | 液氨挥发时会吸收大量的热,可作为制冷剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜、二氧化硫都是电解质 | |
| B. | Fe(OH)3胶体无色、透明,能发生丁达尔现象 | |
| C. | H2、SO2、CO2三种气体都可用浓硫酸干燥 | |
| D. | SiO2既能和氢氧化钠溶液反应也能和氨氟酸反应,所以是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
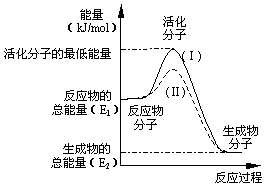 请认真观察图并利用所学的活化能的知识,回答下列问题:
请认真观察图并利用所学的活化能的知识,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T | 298K | 398K | 498K | … |
| K | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业,表格中给出了一些物质的物理常数,请回答下列问题
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业,表格中给出了一些物质的物理常数,请回答下列问题
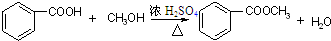 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com