�о�NO
2��SO
2��CO�ȴ�����Ⱦ����IJ���������������Ҫ���壮
��1��I
2O
5��ʹH
2S��CO��HCl�������������ڶ����ⶨCO�ĺ�������֪��
2I
2��s��+5O
2��g��=2I
2O
5��s������H=-75.56kJ?mol
-12CO��g��+O
2��g��=2CO
2��g������H=-566.0kJ?mol
-1�CO��g����I
2O
5��s����Ӧ����I
2��s����CO
2��g�����Ȼ�ѧ����ʽ��
5CO��g��+I2O5��s��=5 CO2��g��+I2��s������H=-1377.22kJ/mol
5CO��g��+I2O5��s��=5 CO2��g��+I2��s������H=-1377.22kJ/mol
��
��2��CO������ȼ�ϵ�أ���KOH��Һ������ʣ��������ֱ����CO�Ϳ��������������У�K+
�˿գ�����ɾ��
�˿գ�����ɾ��
����
��
��
�����������������������Ӧ����ʽΪ��
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
��
��3�����Ͱ��������������Ļ�ѧԭ���Dz��ð�ˮ���������е�SO
2������һ�������������������ղ��ﷴӦ���ü������ŵ�����ܻ�������SO
2�⣬���ܵõ�һ�ָ��Ϸ��ϣ�
�ٸø��Ϸ��Ͽ��ܵĻ�ѧʽΪ
��NH4��3PO4����NH4��2HPO4��NH4H2PO4
��NH4��3PO4����NH4��2HPO4��NH4H2PO4
��д��һ�ּ��ɣ���
������ˮ��SO
2ǡ����ȫ��Ӧ�������Σ����ʱ��Һ��
��
��
�ԣ���ᡱ�����
������������ʵĵ���ƽ�ⳣ�����£���ˮ K
b=1.8��10
-5mol?L
-1H
2SO
3 K
a1=1.3��10
-2mol?L
-1��K
a2=6.3��10
-8mol?L
-1���������Һ��ͨ��
SO2
SO2
�����ʹ��Һ�����ԣ����SO
2����NH
3����
��ʱ��Һ��
��
��
2���������������=����
��4��NO
x����ǿ����Һ�����������Σ������������£�FeSO
4��Һ�ܽ�
��ԭΪNO��д���ù����в���NO��Ӧ�����ӷ���ʽ
3Fe2++NO3-+4H+=3Fe3++NO��+2H2O
3Fe2++NO3-+4H+=3Fe3++NO��+2H2O
��




 ��2011?ɽ�����о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ�������Ҫ���壮
��2011?ɽ�����о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ�������Ҫ���壮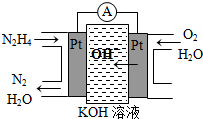 ���£�N2H4���ֳ��������㷺���ڻ���ƽ������л��ϳɼ�ȼ�ϵ�أ�NO2�Ķ�����N2O4���ǻ���г������������Իش���������
���£�N2H4���ֳ��������㷺���ڻ���ƽ������л��ϳɼ�ȼ�ϵ�أ�NO2�Ķ�����N2O4���ǻ���г������������Իش���������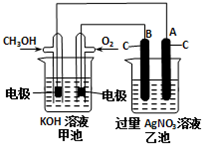 �о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���壮
�о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���壮