
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
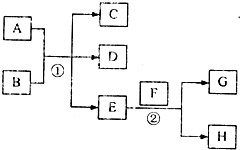 已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)
已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)查看答案和解析>>
科目:高中化学 来源: 题型:
| 主食 | 米饭 |
| 副食 | 土豆、白菜、萝卜汤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/h | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| N2 | 1.500 | 1.400 | 1.200 | a | a | 0.900 | |
| H2 | 4.500 | 4.200 | 3.600 | b | b | 2.700 | 2.100 |
| NH3 | 0 | 0.200 | 0.600 | c | c | 0.200 | 0.600 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 烷烃 | 甲烷 | 乙烷 | 丙烷 | 丁烷 |
| 燃烧热(kJ?mol-1) | 890 | 1 560 | 2 220 | 2 880 |
| A、C5H12(l)+8O2(g)═5CO2(g)+6H2O(l)△H=-3 540 kJ?mol-1 |
| B、C5H12(l)+8O2(g)═5CO2(g)+6H2O(g)△H=-3 540 kJ?mol-1 |
| C、C5H12(l)+8O2(g)═5CO2(g)+6H2O(g)△H=+3 540 kJ?mol-1 |
| D、C5H12(l)+8O2(g)═5CO2(g)+6H2O(l)△H=+3 540 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、温度计插入液体测量温度,同时用它搅拌液体 | ||
B、给试管内液体加热时,液体体积不应超过试管容积的
| ||
| C、浓硫酸与酒精混合,将酒精加入到浓硫酸中 | ||
| D、为加速固体物质的溶解,常采用振荡、搅拌、加热等措施 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④ | B、④⑥ |
| C、③④⑤ | D、④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、20种 | B、19种 |
| C、17种 | D、15种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com