
| 时间/h | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| N2 | 1.500 | 1.400 | 1.200 | a | a | 0.900 | |
| H2 | 4.500 | 4.200 | 3.600 | b | b | 2.700 | 2.100 |
| NH3 | 0 | 0.200 | 0.600 | c | c | 0.200 | 0.600 |
| △c |
| △t |
| 1.5-1.2 |
| 2 |
| c2(NH3) |
| c(N2)?c3(H2) |
| c2 |
| a?b3 |
| c2(NH3) |
| c(N2)?c3(H2) |
| c2 |
| a?b3 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质的量是衡量物质质量大小的物理量 |
| B、摩尔质量即相对分子质量 |
| C、摩尔是物质的量的单位 |
| D、气体摩尔体积是指单位物质的量的物质所占的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、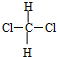 和 和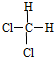 是两种不同的物质 是两种不同的物质 |
| B、淀粉和纤维素水解最终产物都是葡萄糖 |
| C、丁烷有2种同分异构体 |
| D、淀粉、纤维素、蛋白质、油脂都属于天然高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验中使用的主要仪器是普通漏斗、烧杯、铁架台(带铁圈) |
| B、碘在四氯化碳中的溶解度比在水中的溶解度大 |
| C、碘的四氯化碳溶液呈紫色 |
| D、分液时,水层从分液漏斗下口放出,碘的四氯化碳溶液从分液漏斗上口倒出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com