
| A、实验中使用的主要仪器是普通漏斗、烧杯、铁架台(带铁圈) |
| B、碘在四氯化碳中的溶解度比在水中的溶解度大 |
| C、碘的四氯化碳溶液呈紫色 |
| D、分液时,水层从分液漏斗下口放出,碘的四氯化碳溶液从分液漏斗上口倒出 |


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
| 时间/h | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| N2 | 1.500 | 1.400 | 1.200 | a | a | 0.900 | |
| H2 | 4.500 | 4.200 | 3.600 | b | b | 2.700 | 2.100 |
| NH3 | 0 | 0.200 | 0.600 | c | c | 0.200 | 0.600 |
查看答案和解析>>
科目:高中化学 来源: 题型:
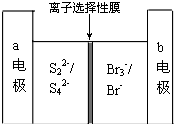 下图是一种正在投入生产的大型蓄电系统的原理图.电池的中间为只允许钠离子通过的离子选择性膜.电池充、放电的总反应方程式为:2Na2S2+NaBr3
下图是一种正在投入生产的大型蓄电系统的原理图.电池的中间为只允许钠离子通过的离子选择性膜.电池充、放电的总反应方程式为:2Na2S2+NaBr3| 放电 |
| 充电 |
| A、充电的过程中当0.1mol Na+通过离子交换膜时,导线通过0.1mol电子 |
| B、电池放电时,负极反应为:3NaBr-2e═NaBr3+2Na |
| C、充电过程中,电极a与电源的正极相连 |
| D、放电过程中钠离子从右到左通过离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、废旧电池应集中回收进行填埋处理 |
| B、少量钠、钾要在干燥的试剂瓶中保存妥善保管 |
| C、目前治理白色污染的方法主要是减少使用、加强回收和再利用 |
| D、为了防止月饼等富脂食品氧化变质,常在包装袋中放入生石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、室温下0.1 mol/L的NaHCO3溶液中,若pH>7,则c(CO
| ||
B、相同条件下,等物质的量浓度的NH4Cl和NH4HSO4溶液,前者溶液中NH
| ||
| C、在室温下,某溶液中由水电离出的c(H+)=10-3 mol/L,则此溶液可能是盐酸 | ||
| D、加水稀释稀醋酸溶液,溶液中所有离子浓度都会减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、20种 | B、19种 |
| C、17种 | D、15种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10 L 0.05 mol?L-1Ba(OH)2溶液与20 L 0.05 mol?L-1 HNO3反应时的反应热是中和热 |
| B、1 mol HCl气体通入1 L 0.01 mol?L-1 NaOH溶液中反应时的反应热是中和热 |
| C、1 mol HClO与2 mol NaOH溶液反应时的反应热也可能是中和热 |
| D、只要强酸与强碱在稀溶液中反应生成1 mol水时的反应热就是中和热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、①② | C、②④ | D、②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com