
 ②KCl
②KCl (3)H2O2
(3)H2O2 ;
;分析 (1)①二氧化碳中存在两个碳氧双键,C、O原子最外层都达到最外层8个电子;
②KCl为离子化合物,由K+和Cl-构成;
③双氧水中两个氢原子分别与两个氧原子通过共用一对电子结合,两个氧原子之间通过共用1对电子结合;
(2)二氧化碳是直线形结构,每个氧原子和碳原子形成碳氧双键;
(3)K+和OH-形成离子键,OH-中O与H之间形成极性键,KOH属于离子化合物,离子晶体.
解答 解:(1)①二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为 ,故答案为:
,故答案为: ;
;
②KCl为离子化合物,由K+和Cl-构成,电子式为 ,故答案为:
,故答案为: ;
;
③双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为 ,故答案为:
,故答案为: ;
;
(2)二氧化碳是直线形结构,每个氧原子和碳原子形成碳氧双键,其结构式为O=C=O,故答案为:O=C=O;
(3)KOH中K+和OH-形成离子键,OH-中O与H之间形成极性键,KOH属于离子化合物,离子晶体,故答案为:离子键和极性键;离子晶体.
点评 本题考查化学用语和化学键、晶体类型,为高频考点,难度不大,掌握电子式、结构式、化学键类型是解题关键.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:解答题
| 苯甲酸 | 乙醇 | 苯甲酸乙酯 | |
| 熔点/℃ | 122.4 | -114.1 | -34.6 |
| 沸点/℃ | 249 | 78.3 | 212.6 |
| 密度/g•cm-3 | 1.2659 | 0.816 | 1.05 |
| 水溶性 | 微溶 | 互溶 | 不溶 |
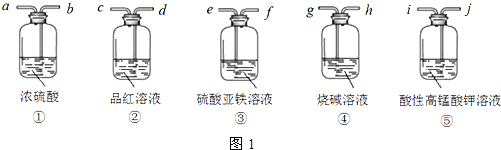
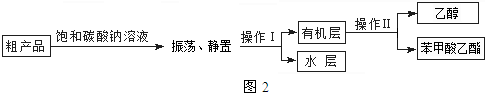
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向饱和AgCl水溶液中加入盐酸,Ksp(AgC1)变大 | |
| B. | AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) | |
| C. | 温度一定,当溶液中c(Ag+)c(Cl- )<Ksp(AgCl)时,此溶液中必有AgCl沉淀析出 | |
| D. | 向AgI的悬浊液中加NaCl浓溶液,可能有AgCl生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消耗1 mol CH3CH2OH时转移电子的物质的量为4mol | |
| B. | 1mol/L CH3COOH溶液中含有σ键的数目为7NA个 | |
| C. | H2F+、NH2-、H2S、CH4均与H2O互为等电子体 | |
| D. | 在配合物[Cr(H2O)6]3+中,H、O原子与中心离子Cr3+形成配位键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | S | SCl2 | S2Cl2 |
| 沸点/℃ | 445 | 59 | 137 |
| 熔点/℃ | 113 | -122 | -77 |
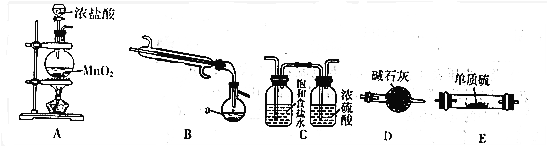
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径C>D>E,三者形成的简单离子中D离子的半径最小 | |
| B. | 元素A所形成的氢化物常温下一定为气态 | |
| C. | 元素C、D、E在自然界中均不能以游离态存在 | |
| D. | 元素B的氧化物对应的水化物一定为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
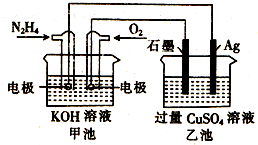
| A. | 该装置工作时,Ag电极上有气体生成 | |
| B. | 甲池中负极反应为N2H4-4e-=N2+4H+ | |
| C. | 甲池和乙池中的溶液的pH均减小 | |
| D. | 当甲池中消耗0.1mol N2H4时,乙池中理论上最多产生6.4g固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com