
【题目】下列指定反应的离子方程式正确的是( )
A. 向氨水中通入过量SO2:NH3·H2O+SO2===NH4++HSO3-
B. Si与NaOH溶液反应:Si+2OH-+H2O===SiO32-+H2↑
C. 电解MgCl2溶液:2H2O+2Cl-![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
D. Ba(OH)2溶液中滴入NaHSO4溶液至Ba2+恰好完全沉淀:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
科目:高中化学 来源: 题型:
【题目】A、B、C、X为中学化学常见物质,且A、B、C含有相同元素甲,可以发生如下转化关系(水参与的反应,水未标出)。
![]()
(1)若A、B、C的焰色反应呈黄色,C为淡黄色固体,则X是__________。
(2)若A、B、C的焰色反应呈黄色,X是CO2,写出B→C反应的方程式_________。
(3)若B是FeCl3,则X一定是_________,写出B→C反应的离子方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)联氨(又称肼,N2H4,无色液体)为二元弱碱,在水中的电离方式与氨相似。写出在水中联氨第一步电离反应的方程式_______________。氯化镁溶液在某条件下可生Mg(OH)Cl沉淀,请写出相关离子方程式_________
(2)实验室可通过向盛装有碱石灰的锥形瓶中滴加浓氨水来制取氨气,请利用相关化学反应原理来解释______________________________
(3)室温下向10mL0.1 mol/L NaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如图所示
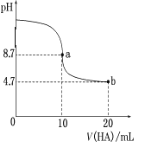
则HA为_______电解质(填“强”或“弱”),a点所示溶液c(Na)_____c(A)(填“>”、“<”或“”=),a、b两点所示溶液中水的电离程度a_______b(填“>”、“<”或“"=)。
(4)25℃时0.05mol/L的醋酸溶液,pH=______ 该溶液中水电离出的c(H+)=____(已知室温下醋酸电离平衡常数为2.0×10-5)
(5)常温下,0.01mol/L的HCN溶液加水稀释1000倍的过程中,下列选项增大的是_____
A.![]() B.Kac(HCN) C.
B.Kac(HCN) C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾常用作消毒杀菌、水质净化剂等。某小组用软锰矿(主要含MnO2,还含有少量SiO2、Al2O3、Fe2O3等杂质)模拟工业制高锰酸钾流程如下。试回答下列问题。
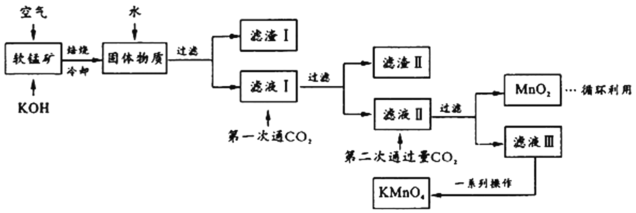
(1)配平焙烧时化学反应:________MnO2+________+________O2![]() ________K2MnO4+________H2O;工业生产中采用对空气加压的方法提高MnO2利用率,试用碰撞理论解释其原因___________________________。
________K2MnO4+________H2O;工业生产中采用对空气加压的方法提高MnO2利用率,试用碰撞理论解释其原因___________________________。
(2)滤渣Ⅱ的成分有_________(化学式);第一次通CO2不能用稀盐酸代替的原因是_____________。
(3)第二次通入过量CO2生成MnO2的离子方程式为________________________。
(4)将滤液Ⅲ进行一系列操作得KMnO4。
由图可知,从滤液Ⅲ得到KMnO4需经过__________、___________、洗涤等操作。
(5)工业上按上述流程连续生产。含MnO2 a%的软锰矿1吨,理论上最多可制KMnO4____________吨。(保留到小数点后三位)
(6)利用电解法可得到更纯的KMnO4用惰性电极电解滤液Ⅱ。
①电解槽阳极反应式为________________________________。
②阳极还可能有气体产生,该气体是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述一定正确的是( )
A.2.0gH218O和D2O的混合物中含有质子数为NA
B.1.0L 2.0 mol/L NaOH溶液中含有氧原子数为2NA
C.3.4gH2O2参加氧化还原反应时转移电子数一定为0.1NA
D.常温下,1mol的NaHSO4晶体中含阳离子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2与CH4可制得合成气:CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH=+247 kJ·mol-1。初始温度均为T K时,在3个容器中按不同方式投入反应物,发生上述反应,相关信息如下表:
容器 | 起始物质的量/mol | CO2平衡转化率(α) | |||||
编号 | 容积/L | 条件 | CH4(g) | CO2(g) | CO(g) | H2(g) | |
Ⅰ | 2 | 恒温恒容 | 2 | 1 | 0 | 0 | 50% |
Ⅱ | 1 | 0.5 | 1 | 0 | 0 | ||
Ⅲ | 1 | 绝热恒容 | 1 | 0.5 | 0 | 0 | - |
下列说法正确的是
A.T K时,反应CH4(g)+CO2(g)2CO(g)+2H2(g)的平衡常数为1/3
B.容器Ⅱ中反应达到平衡时,α(CO2,Ⅱ)=50%
C.容器Ⅲ中反应达到平衡时反应热在123.5—247 kJ·mol-1范围内
D.容器Ⅱ中反应达到平衡时,再投入0.5 mol CH4、0.25 mol CO,反应达到新平衡前,v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.常温下,浓度均为0.1 mol·L-1的六种溶液的pH如下表所示:

请回答下列问题:
(1)上述六种溶液中,水的电离程度最小的是_____(填化学式)。
(2)若欲增大氯水中次氯酸的浓度,可向氯水中加入上表中的物质是_____(填写一种物质即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:

已知:①Cl2+2OH![]() ClO+Cl+H2O是放热反应。
ClO+Cl+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________。
(2)步骤Ⅱ合成N2H4·H2O的装置如题19图1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________;使用冷凝管的目的是_________________________________。

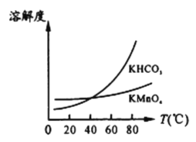
(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、![]() 、
、![]() 随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。
随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。

①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为_________________。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案: _______________________,用少量无水乙醇洗涤,干燥,密封包装。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置完成相关实验,合理的是( )。

A. 图①:验证H2CO3酸性强于H2SiO3 B. 图②:收集CO2或NH3
C. 图③:分离Na2CO3溶液与CH3COOC2H5 D. 图④:分离C2H5OH与CH3COOC2H5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com