
【题目】.常温下,浓度均为0.1 mol·L-1的六种溶液的pH如下表所示:

请回答下列问题:
(1)上述六种溶液中,水的电离程度最小的是_____(填化学式)。
(2)若欲增大氯水中次氯酸的浓度,可向氯水中加入上表中的物质是_____(填写一种物质即可)。
【答案】Na2SO4 NaHCO3或NaClO或CH3COONa(填写一种物质即可)。
【解析】
(1)酸碱抑制水的电离,可水解的盐促进水的电离,强酸强碱盐对水的电离无影响;
(2)首先根据越弱越水解原理判断,得出酸性顺序为:CH3COOH>H2CO3>HClO>HCN>HCO3-,再根据氯水中的平衡移动以及强酸制弱酸的原理选择合适的物质。
(1)只有Na2SO4是强酸强碱盐,对水的电离无影响,其余均为弱酸强碱盐,均促进水的电离,故水的电离程度最小的是Na2SO4,故答案为:Na2SO4;
(2)根据越弱越水解原理,可知弱酸越弱,其对应弱酸根离子的水解程度越大,溶液碱性越强,根据上表几种强碱弱酸盐的pH可得,酸性顺序为:CH3COOH>H2CO3>HClO>HCN>HCO3-。氯气溶于水后和水反应生成盐酸和次氯酸,该反应为可逆反应:Cl2+ H2O HCl + HClO,要增大HClO的浓度,可消耗HCl,使平衡正向移动,但不能消耗HClO,根据强酸制弱酸的原理,可知NaHCO3、NaClO、CH3COONa可与HCl反应,而不与HClO反应,且NaClO一方面消耗盐酸,同时生成HClO,故答案为:NaHCO3或NaClO或CH3COONa(填写一种物质即可)。


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是( )
A.16.25gFeCl3水解形成的Fe(OH)3胶体粒子数小于0.1NA
B.22.4L(标准状况)氩气含有的分子数为0.5NA
C.标准状况下,2.24LN2和O2的混合气体中分子数为0.2NA
D.2.4gMg与H2SO4完全反应,转移的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的叙述一定不正确的是
A. 向FeCl2溶液中滴加NH4SCN溶液,溶液显红色
B. KAl(SO4) 2·12H2O溶于水可形成 Al(OH)3胶体
C. NH4Cl与Ca(OH)2混合加热可生成NH3
D. Cu与FeCl3溶液反应可生成CuCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. 向氨水中通入过量SO2:NH3·H2O+SO2===NH4++HSO3-
B. Si与NaOH溶液反应:Si+2OH-+H2O===SiO32-+H2↑
C. 电解MgCl2溶液:2H2O+2Cl-![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
D. Ba(OH)2溶液中滴入NaHSO4溶液至Ba2+恰好完全沉淀:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论正确的是
A. 是Ba(OH)2溶液中滴加NaHSO4溶液之后,溶液的导电能力随滴入NaHSO4溶液体积变化的曲线,说明a点对应的溶液呈碱性
是Ba(OH)2溶液中滴加NaHSO4溶液之后,溶液的导电能力随滴入NaHSO4溶液体积变化的曲线,说明a点对应的溶液呈碱性
B. 表示某放热反应分别在有、无催化剂的情况下,反应过程中的能量变化
表示某放热反应分别在有、无催化剂的情况下,反应过程中的能量变化
C. 是I2+I-I3-中I3-的平衡浓度随温度变化的曲线,说明平衡常数K(T1)<K(T2)
是I2+I-I3-中I3-的平衡浓度随温度变化的曲线,说明平衡常数K(T1)<K(T2)
D. 是室温下用0.1 mol·L-1 NaOH溶液滴定0.1 mol·L-1某酸HX的滴定曲线,说明可用甲基橙判断该反应的终点
是室温下用0.1 mol·L-1 NaOH溶液滴定0.1 mol·L-1某酸HX的滴定曲线,说明可用甲基橙判断该反应的终点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国具有悠久的历史,在西汉就有湿法炼铜(Fe+CuSO4=Cu+FeSO4),试回答下列问題。
(1)Cu2+的未成对电子数有_____个,H、O、S电负性由大到小的顺序为______________________。
(2)已知[Cu(NH3)4]SO4是一种配合物。
①[Cu(NH3)4]SO4中化学键类型有______________,[Cu(NH3)4]2+的结构简式为_________________。阴离子中心原子杂化类型为____________________。
②NH3、H2O、HF的沸点由高到低为_________________。
(3)铁铜合金晶体类型为________________;铁的第三(I3)和第四(I4)电离能分别为2957 kJ/mol、5290 kJ/mol,比较数据并分析原因________________。
(4)金铜合金的一种晶体结构为立方晶型,如图所示。
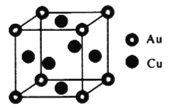
①该合金的化学式为_______________。
②已知该合金的密度为d g/cm3,阿伏加徳罗常数值为NA,则该晶胞的棱长为__________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨为重要化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a.CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+216.4kJ/mol
b.CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.2kJ/mol
则反应CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=_____________kJ/mol
(2)起始时投入氮气和氢气分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度关系如图。
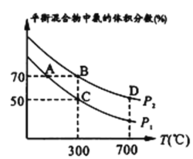
①恒压时,反应一定达到平衡状态的标志是__________ (填序号);
A.N2和H2的转化率相等
B.反应体系密度保持不变
C.![]() 比值保持不变
比值保持不变
D.![]() =2
=2
②P1________P2(填“>”、“<”、“=”、“不确定”,下同);反应平衡常数:B点______D点;
③C点H2的转化率_______________;在A、B两点条件下,该反应从开始到平衡时生成氨气平均速率:v(A)_______v(B)。
(3)N2H4可作火箭推进剂,NH3和NaClO在一定条件下反应可生成N2H4。
①写出NH3和NaClO反应生成N2H4的化学方程式_____________________________________________。
②当转移电子量为0.3NA时,标况下消耗NH3____________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。如图表示N2O在Pt2O+表面与CO反应转化成无害气体的过程。下列说法正确的是
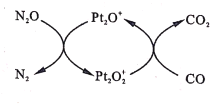
A.N2O转化成无害气体时的催化剂是Pt2O2+
B.每1mol Pt2O+转化为Pt2O2+得电子数为3NA
C.将生成的CO2通人含大量SiO32-、Na+、Cl-的溶液中,无明显现象
D.1g CO2 、N2O的混合气体中含有电子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是几种常见有机物的转化关系,下列说法正确的是

A. 反应①是加成反应,反应⑧是消去反应,其他所标明的反应都是取代反应
B. 上述物质中能与NaOH溶液反应的只有乙酸
C. 1,2-二溴乙烷、乙烯、乙醇烃基上的氢原子被氯原子取代,其一氯取代产物都是一种
D. 等物质的量的乙烯和乙醇与足量氧气反应时耗氧量相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com