
【题目】设NA为阿伏加德罗常数值。如图表示N2O在Pt2O+表面与CO反应转化成无害气体的过程。下列说法正确的是
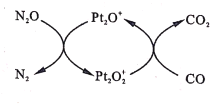
A.N2O转化成无害气体时的催化剂是Pt2O2+
B.每1mol Pt2O+转化为Pt2O2+得电子数为3NA
C.将生成的CO2通人含大量SiO32-、Na+、Cl-的溶液中,无明显现象
D.1g CO2 、N2O的混合气体中含有电子数为0.5NA
【答案】D
【解析】
A.根据转化关系,N2O转化N2时,Pt2O+转化为Pt2O2+,则该过程的催化剂是Pt2O+,故A错误;
B.根据转化关系,结合得失电子守恒, N2O转化N2时,Pt2O+转化为Pt2O2+,氧化还原反应方程式为:N2O+ Pt2O+= N2+ Pt2O2+,反应中氮元素由+1价得电子变为0价,1mol N2O转化为N2得到2mol电子,则每1mol Pt2O+转化为Pt2O2+失电子为2mol,数目为2NA,故B错误;
C.将生成的CO2通人含大量SiO32-、Na+、Cl-的溶液中,碳酸的酸性大于硅酸,SiO32-+CO2(少量)+H2O=CO32-+H2SiO3↓,有白色沉淀生成,故C错误;
D.CO2和N2O的摩尔质量都为44g/mol,一个分子中含有电子数都为22个,则 1g CO2 、N2O的混合气体的物质的量为![]() mol,含有电子数为
mol,含有电子数为![]() mol ×22×NA=0.5NA,故D正确;
mol ×22×NA=0.5NA,故D正确;
答案选D。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】硫化氢毒性很大,俗称“一口闷”,工业废水中的硫化物在酸性条件下会以硫化氢的形式逸出。某课外小组以碘量法测定废水中的硫化物,实验装置如图所示,实验步骤及测定原理如下:
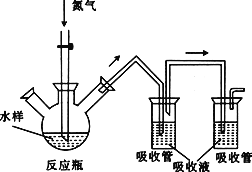
Ⅰ.取样、吹气、固硫
连接装置,打开氮气源,检查装置气密性。移取一定体积1mol·L-1乙酸锌溶液于两支吸收管中,取200mL水样于反应瓶中,通入氮气一段时间。移取10mL盐酸于反应瓶中,水浴加热,继续通入氮气。已知乙酸锌与硫化氢反应生成硫化锌沉淀(硫化氢被完全吸收)。
Ⅱ.滴定
关闭气源,往两个吸收管中各加入0.010mol·L-1的碘标准溶液100mL(过量),再加入盐酸5mL,静置。加入淀粉指示液,用0.010mol·L-1的硫代硫酸钠标准溶液对两支吸收管中的液体进行滴定。(已知:![]() )
)
回答下列问题:
(1)水浴加热的温度不能高于85℃,原因是_____________________________。
(2)加入碘标准溶液时,吸收管中发生反应的化学方程式为________________。
(3)该实验使用两个吸收管的原因是_____________________________,若只使用一个吸收管,会导致测定结果偏______________________(填“高”或“低”)。
(4)该200mL水样经吹气、固硫后,滴定操作时共消耗160mLNa2S2O3溶液,则废水中硫的含量为________mg·L-1。
(5)实验室常用FeS固体与酸反应制取H2S。实验室制取H2S时,从反应物与生成物的状态、性质和反应条件分析,下列发生装置中可选用的是________(填序号)。

(6)将二氧化氯溶液加入硫化氢溶液中,然后加入少量稀盐酸酸化的氯化钡溶液,发现有白色沉淀生成。写出二氧化氯与硫化氢溶液反应的离子方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列正确的叙述有
① CO2、SO2、P2O5均为酸性氧化物
②Ca(HCO3)2 、Fe(OH)3、FeCl2均可由化合反应制得
③ 碘晶体分散到酒精中、淀粉溶于水中所形成的分散系分别为:溶液、胶体
④ 灼热的炭与CO2的反应、Ba(OH)2·8H2O与NH4Cl的反应均属于氧化还原反应,又是吸热反应
⑤ 需要通电才可进行的有:电离、电解、电泳、电镀、电化学腐蚀
⑥ 氯化铁溶液与氢氧化铁胶体具有的共同性质是:能透过滤纸,加热蒸干、灼烧后都有氧化铁生成
⑦ 按照纯净物、混合物、强电解质、弱电解质和非电解质顺序排列的是CuSO4·5H2O、盐酸、苛性钾、次氯酸、氨气
⑧ 金属元素和非金属元素形成的化合物不一定是离子化合物
A. 3个B. 4个C. 5个D. 6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如下图所示。
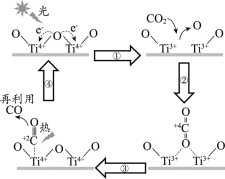
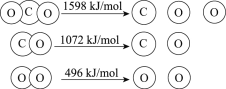
下列说法正确的是
A.过程①中钛氧键断裂会释放能量
B.该反应中,光能和热能转化为化学能
C.使用TiO2作催化剂可以降低反应的焓变,从而提高化学反应速率
D.CO2分解反应的热化学方程式为2CO2(g) =2CO(g) + O2(g) ΔH= + 30 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二硫化钼是重要的固体润滑剂,被誉为“高级固体润滑油之王”。利用低品相的辉钼矿(含MoS2、SiO2以及CuFeS2等杂质)制备高纯二硫化钼的一种生产工艺如图:
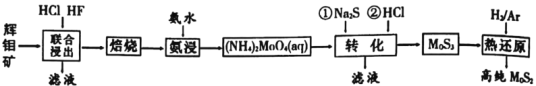
(1)(NH4)2MoO4中Mo的化合价为___。
(2)“焙烧”时MoS2转化为MoO3的化学方程式为___。
(3)“转化”中第一步加入Na2S后,(NH4)2MoO4转化为(NH4)2MoS4,写出第二步(NH4)2MoS4与盐酸生成MoS3的离子方程式为___。
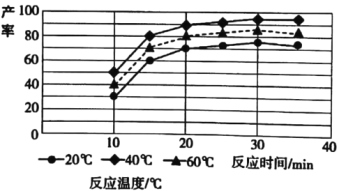
(4)由图分析可知产生MoS3沉淀的流程中选择的最优温度和时间是__,利用化学平衡原理分析低于或高于最优温度时,MoS3的产率均下降的原因___。
(5)利用低品相的原料制备高纯产品是工业生产中的普遍原则。如图所示,反应[Ni(s)+4CO(g)![]() Ni(CO)4(g)] ΔH<0在充满CO的石英管中进行,先在温度为T2的一端放入未提纯的粗镍粉末,一段时间后,在温度为T1的一端得到了纯净的镍粉,请结合平衡移动原理,判断温度Tl___T2(填“>”、“<”或“=”)。
Ni(CO)4(g)] ΔH<0在充满CO的石英管中进行,先在温度为T2的一端放入未提纯的粗镍粉末,一段时间后,在温度为T1的一端得到了纯净的镍粉,请结合平衡移动原理,判断温度Tl___T2(填“>”、“<”或“=”)。

(6)已知Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8,不纯的Na2MoO4溶液中若含少量可溶性硫酸盐杂质,可加入Ba(OH)2固体除去SO42-(忽略溶液体积变化),则当SO42-完全沉淀时,溶液中c(MoO42-)<___mol/L(保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的分子式为C4H8O2,已知A~E有下列转化关系如下,试回答下列问题:

(1)C中的官能团名称是_______;
(2)E的结构简式是_______。
(3)在图中①~④的反应中,属于氧化反应的有________。
(4)写出反应②的化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下反应的化学方程式或离子方程
(1)铝与氧化铁在高温下反应(铝热反应)______________;
(2)医学上,用(胃舒平)氢氧化铝治疗胃酸过多,写出反应的离子方程式____________;
(3)工业上用焦炭和二氧化硅反应制得粗硅(Si)______________;
(4)苯的硝化反应______________;
(5)乙醇和钠反应______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是一种用途广泛的精细化工产品。工业生产乙酸乙酯的方法很多,如图:

下列说法正确的是
A. 反应①、②均是取代反应
B. 反应③、④的原子利用率均为100%
C. 与乙酸乙酯互为同分异构体的酯类化合物有2种
D. 乙醇、乙酸、乙酸乙酯三种无色液体可用Na2CO3溶液鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应S2O82-(aq)+2I-(aq)![]() 2SO42-(aq)+I2(aq),若往该溶液中加人含Fe3+的某溶液,反应机理:①2Fe3++(aq)+2I-(aq)
2SO42-(aq)+I2(aq),若往该溶液中加人含Fe3+的某溶液,反应机理:①2Fe3++(aq)+2I-(aq)![]() I2(aq)+2Fe2+(aq)②2Fe2+(aq)+S2O82-(aq)
I2(aq)+2Fe2+(aq)②2Fe2+(aq)+S2O82-(aq) ![]() 2Fe3+(aq)+2SO42-(aq),下列有关该反应的说法不正确的是
2Fe3+(aq)+2SO42-(aq),下列有关该反应的说法不正确的是
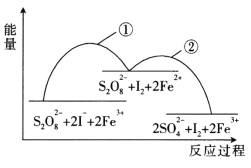
A.增大S2O82-浓度或I-浓度,反应①、反应②的反应速率均加快
B.Fe3+是该反应的催化剂
C.因为正反应的活化能比逆反应的活化能小,所以该反应是放热反应
D.往该溶液中滴加淀粉溶液,溶液变蓝,适当升温,蓝色加深
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com