
【题目】二硫化钼是重要的固体润滑剂,被誉为“高级固体润滑油之王”。利用低品相的辉钼矿(含MoS2、SiO2以及CuFeS2等杂质)制备高纯二硫化钼的一种生产工艺如图:
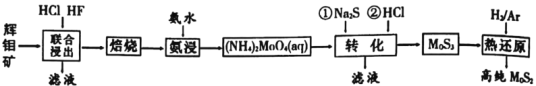
(1)(NH4)2MoO4中Mo的化合价为___。
(2)“焙烧”时MoS2转化为MoO3的化学方程式为___。
(3)“转化”中第一步加入Na2S后,(NH4)2MoO4转化为(NH4)2MoS4,写出第二步(NH4)2MoS4与盐酸生成MoS3的离子方程式为___。
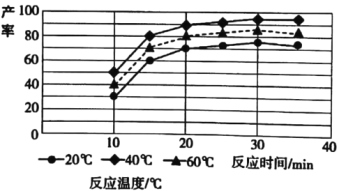
(4)由图分析可知产生MoS3沉淀的流程中选择的最优温度和时间是__,利用化学平衡原理分析低于或高于最优温度时,MoS3的产率均下降的原因___。
(5)利用低品相的原料制备高纯产品是工业生产中的普遍原则。如图所示,反应[Ni(s)+4CO(g)![]() Ni(CO)4(g)] ΔH<0在充满CO的石英管中进行,先在温度为T2的一端放入未提纯的粗镍粉末,一段时间后,在温度为T1的一端得到了纯净的镍粉,请结合平衡移动原理,判断温度Tl___T2(填“>”、“<”或“=”)。
Ni(CO)4(g)] ΔH<0在充满CO的石英管中进行,先在温度为T2的一端放入未提纯的粗镍粉末,一段时间后,在温度为T1的一端得到了纯净的镍粉,请结合平衡移动原理,判断温度Tl___T2(填“>”、“<”或“=”)。

(6)已知Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8,不纯的Na2MoO4溶液中若含少量可溶性硫酸盐杂质,可加入Ba(OH)2固体除去SO42-(忽略溶液体积变化),则当SO42-完全沉淀时,溶液中c(MoO42-)<___mol/L(保留2位有效数字)。
【答案】+6 2MoS2+7O2![]() 2MoO3+4SO2 MoS42-+2H+
2MoO3+4SO2 MoS42-+2H+![]() MoS3↓+H2S↑ 40℃、30min 温度太低,反应MoS42-+2H+
MoS3↓+H2S↑ 40℃、30min 温度太低,反应MoS42-+2H+![]() MoS3↓+H2S↑产生的H2S气体不易逸出,不利于平衡正向移动生成MoS3;温度太高,反应物盐酸挥发,导致溶液中c(H+)下降,上述平衡逆向移动,也不利于生成MoS3 > 3.6×10-3
MoS3↓+H2S↑产生的H2S气体不易逸出,不利于平衡正向移动生成MoS3;温度太高,反应物盐酸挥发,导致溶液中c(H+)下降,上述平衡逆向移动,也不利于生成MoS3 > 3.6×10-3
【解析】
(1)根据化合物中元素化合价代数和等于0计算(NH4)2MoO4中Mo的化合价;
(2)“焙烧”时MoS2和氧气反应生成MoO3和SO2;
(3)第二步(NH4)2MoS4与盐酸发生复分解反应生成MoS3、氯化铵、硫化氢;
(4)根据图象可知,40℃、30min MoS3沉淀率达到最大;温度太低,产生的H2S气体不易逸出;温度太高,反应物盐酸挥发;
(5)Ni(s)+4CO(g)![]() Ni(CO)4(g) ΔH<0,正反应放热,升高温度平衡逆向移动,生成Ni单质;
Ni(CO)4(g) ΔH<0,正反应放热,升高温度平衡逆向移动,生成Ni单质;
(6)根据Ksp(BaSO4)计算SO42-完全沉淀时,溶液中c(Ba2+),再根据Ksp(BaMoO4)计算c(MoO42-);
(1)化合物中元素化合价代数和等于0,所以(NH4)2MoO4中Mo的化合价为+6;
(2)“焙烧”时MoS2和氧气反应生成MoO3和SO2,根据得失电子守恒配平方程式为2MoS2+7O2![]() 2MoO3+4SO2;
2MoO3+4SO2;
(3)第二步(NH4)2MoS4与盐酸发生复分解反应生成MoS3、氯化铵、硫化氢,反应的离子方程式为MoS42-+2H+![]() MoS3↓+H2S↑;
MoS3↓+H2S↑;
(4)根据图象可知,40℃、30min MoS3沉淀率达到最大,所以最优温度和时间是40℃、30min;温度太低,反应MoS42-+2H+![]() MoS3↓+H2S↑产生的H2S气体不易逸出,不利于平衡正向移动生成MoS3;温度太高,反应物盐酸挥发,导致溶液中c(H+)下降,上述平衡逆向移动,也不利于生成MoS3,所以低于或高于最优温度时,MoS3的产率均下降;
MoS3↓+H2S↑产生的H2S气体不易逸出,不利于平衡正向移动生成MoS3;温度太高,反应物盐酸挥发,导致溶液中c(H+)下降,上述平衡逆向移动,也不利于生成MoS3,所以低于或高于最优温度时,MoS3的产率均下降;
(5)[Ni(s)+4CO(g)![]() Ni(CO)4(g)] ΔH<0,正反应放热,升高温度平衡逆向移动,生成Ni单质,在温度为T1的一端得到了纯净的镍粉,所以Tl>T2;
Ni(CO)4(g)] ΔH<0,正反应放热,升高温度平衡逆向移动,生成Ni单质,在温度为T1的一端得到了纯净的镍粉,所以Tl>T2;
(6)Ksp(BaSO4)= 1.1×10-10,SO42-完全沉淀时,溶液中c(Ba2+)=![]() , Ksp(BaMoO4)= 4.0×10-8,c(MoO42-)=
, Ksp(BaMoO4)= 4.0×10-8,c(MoO42-)=![]() 3.6×10-3。
3.6×10-3。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
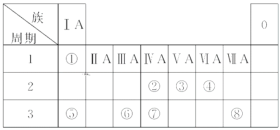
(1)上述八种元素中,最高价氧化物的水化物酸性最强的化合物的化学式是________(填化学符号,下同),最高价氧化物的水化物碱性最强的化合物的化学式是________,最高价氧化物的水化物显两性的氢氧化物的化学式是________。
(2)③与④的气态氢化物的稳定性由大到小的顺序是___________________。
(3)④、⑤、⑥的简单离子半径由大到小的顺序是 ___________________。
(4)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人剧烈运动后肌肉发酸是因为当体内氧气缺少时葡萄糖发生反应产生了乳酸,其结构简式为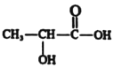 。下列关于乳酸的说法正确的是( )
。下列关于乳酸的说法正确的是( )
A.乳酸的系统命名为1-羟基丙酸
B.与乳酸具有相同官能团的所有同分异构体(包括乳酸)共3种
C.乳酸既可发生取代反应、消去反应又可发生加成反应
D.乳酸发生缩聚反应的方程式为n +nH2O
+nH2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外兴趣小组为探究铜与浓硫酸的反应,用下图所示装置时行实验:
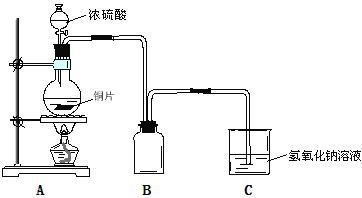

(1)B是用来收集实验中产生的气体的装置,装置图补充完整后正确的是__________;

(2)实验中他们取6.4g铜片和12mL 18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组中的同学认为还有一定量的硫酸剩余。
① 请写出铜跟浓硫酸反应的化学方程式:_____________________________________。
②下列试剂中,能证明反应停止后烧瓶中有硫酸剩余的是___________(填写字母编号)。
A.硫酸钠溶液 | B.BaCl2溶液 | C.银粉 | D.Na2CO3溶液 |
③为什么有一定量的硫酸剩余但未能使铜片完全溶解?你认为原因是__________________________。
(3)为了确定反应生成的主要气体成分,还可以在实验装置A和B之间补充以上右图D装置,其中洗气瓶中可以盛有__________(试剂)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)元素C、N、O、K的电负性从大到小依次为______。
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为______。
(3)下图是周期表中短周期的一部分,A的单质是空气中含量最多的物质,其中第一电离能最小的元素是______(填“A”“B”“C”或“D”)。
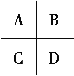
(4)氮化硼(BN)是一种重要的功能陶瓷材料。基态B原子的电子排布式为______;B和N相比,电负性较大的是______,BN中B元素的化合价为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。如图表示N2O在Pt2O+表面与CO反应转化成无害气体的过程。下列说法正确的是
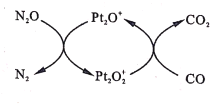
A.N2O转化成无害气体时的催化剂是Pt2O2+
B.每1mol Pt2O+转化为Pt2O2+得电子数为3NA
C.将生成的CO2通人含大量SiO32-、Na+、Cl-的溶液中,无明显现象
D.1g CO2 、N2O的混合气体中含有电子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质的电子式:
(1)CaCl2:___;Na2S:___;HCl:___。
写出下列物质的结构式:
(2)HClO:___;CO2:___;N2:___。
写出下列物质的结构示意图:
(3)Ca:___;Mg2+:___;F-:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物W 在工业上常用作溶剂和香料,其合成方法如下:
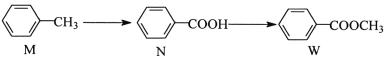
下列说法正确的是( )
A. M、N、W 均能发生加成反应、取代反应
B. N、W 组成上相差一个CH2原子团,所以互为同系物
C. W 属于酯类,酸性水解和碱性水解产物相同
D. 1mol N可与4mol H2发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com