
【题目】某有机物A的分子式为C4H8O2,已知A~E有下列转化关系如下,试回答下列问题:

(1)C中的官能团名称是_______;
(2)E的结构简式是_______。
(3)在图中①~④的反应中,属于氧化反应的有________。
(4)写出反应②的化学方程式_______。
【答案】羧基 CH3CHO ②④ 2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
【解析】
有机物A的分子式为C4H8O2,它能在NaOH溶液中发生水解生成B与D,则A属于酯,B酸化得到C,D连续氧化也得到C,则D为醇、C为羧酸,且二者均含有2个碳原子,故B为CH3COONa,C为CH3COOH,D为CH3CH2OH,E为CH3CHO,A为CH3COOCH2CH3,据此解答。
根据上述分析可知:A为CH3COOCH2CH3,B为CH3COONa,C为CH3COOH,D为CH3CH2OH,E为CH3CHO。
(1)C为CH3COOH,可知C中的官能团-COOH的名称是羧基;
(2)E的结构简式是CH3CHO;
(3)在图中①~④的反应中,①属于取代反应,②④属于氧化反应,③属于复分解反应,故上述反应中属于氧化反应的序号为②④;
(4)D为CH3CH2OH,E为CH3CHO,由于羟基连接的C原子上含有2个H原子,因此可以与O2在Cu作催化剂条件下加热,发生氧化反应产生CH3CHO,故反应②的化学方程式为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O。
2CH3CHO+2H2O。


科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77kJ·mol-1
CH3OH(g) △H3=-90.77kJ·mol-1
回答下列问题:
(1)反应Ⅱ的△H2=______________。
(2)反应Ⅲ能够自发进行的条件是__________ (填“较低温度”、“ 较高温度”或“任何温度”)
(3)恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是________。
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1
D.甲醇的百分含量不再变化
(4)对于反应Ⅰ,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是__________。

A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
B.温度低于250℃时,随温度升高甲醇的产率增大
C.M点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(5)若在1L密闭容器中充入3molH2和1molCO2发生反应Ⅰ,250℃时反应的平衡常数K=______;若要进一步提高甲醇体积分数。可采取的措施有_________________。
(6)下图是电解Na2CO3溶液的装置图。

阴极的电极反应式为________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工艺流程如下:( )
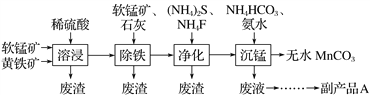
已知:净化工序的目的是除去溶液中的Ca2+、Cu2+等杂质(CaF2难溶)。
下列说法不正确的是
A. 研磨矿石、适当升高温度均可提高溶浸工序中原料的浸出率
B. 除铁工序中,在加入石灰调节溶液的pH前,加入适量的软锰矿,发生的反应为MnO2+2Fe2++4H+===2Fe3++Mn2++2H2O
C. 副产品A的化学式(NH4)2S
D. 从沉锰工序中得到纯净MnCO3的操作方法是过滤、洗涤、干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向a L密闭容器中加入1 mol X气体和2 mol Y气体,发生如下反应:X(g)+2Y(g)![]() 2Z(g),不能说明此反应达到平衡的标志是( )
2Z(g),不能说明此反应达到平衡的标志是( )
A.容器内压强不随时间变化
B.容器内各物质的百分含量不随时间变化
C.容器内X、Y、Z的浓度之比为1:2:2
D.v正(X)=2v逆(Y)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。如图表示N2O在Pt2O+表面与CO反应转化成无害气体的过程。下列说法正确的是
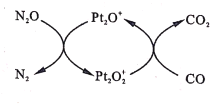
A.N2O转化成无害气体时的催化剂是Pt2O2+
B.每1mol Pt2O+转化为Pt2O2+得电子数为3NA
C.将生成的CO2通人含大量SiO32-、Na+、Cl-的溶液中,无明显现象
D.1g CO2 、N2O的混合气体中含有电子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有相同电子层数、原子序数相连的三种元素X、Y、Z,最高价氧化物对应水化物的酸性相对强弱是:![]() ,则下列判断正确的是()
,则下列判断正确的是()
A.形成的气态氢化物的稳定性:X<Y<Z
B.原子半径:X>Y>Z
C.原子序数:X>Y>Z
D.得电子能力:X<Y<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应由两步反应A![]() B
B![]() C构成,反应过程中的能量变化曲线如图(E1、E3表示两反应的活化能)。下列有关叙述正确的是( )
C构成,反应过程中的能量变化曲线如图(E1、E3表示两反应的活化能)。下列有关叙述正确的是( )

![]()
A. 两步反应均为吸热反应 B. 三种化合物的稳定性顺序:B﹤A﹤C
C. 加入催化剂不改变反应的焓变,但能提高转化率 D. 整个反应的ΔH=E1-E2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬钾矾[KCr(SO4)2˙12H2O]在鞣革、纺织等工业上有广泛的用途。某学习小组用还原K2Cr2O7,酸性溶液的方法制备铬钾矾,装置如图所示:
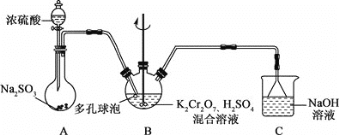
回答下列问题:
(1)A中盛装浓硫酸的仪器名称是________。
(2)装置B中反应的离子方程式为_________________________________。
(3)反应结束后,从B装置中获取铬钾矾晶体的方法是:向混合物中加入乙醇后析出晶体,过滤、洗涤、低温干燥,得到产品。
①加入乙醇后再进行过滤的目的是____________。
②低温干燥的原因是_________________________。
(4)铬钾矾样品中铬含量的测定:取mg样品置于锥形瓶中用适量水溶解,加入足量的Na2O2进行氧化,然后用硫酸酸化使铬元素全部变成Cr2O72-,用c mol/L的FeSO4溶液滴定至终点,消耗FeSO4溶液v mL,该样品中铬的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将amolA与15molB的混合气体通入一固定体积为5L的密闭容器中,发生如下反应:A(g)+3B(g)![]() 2C(g)
2C(g)
(1)若反应进行到10min时达到平衡,n1(A)=13mol,n1(C)=6mol,;计算a的值___;这段时间内的C平均反应速率为___。
(2)反应达平衡时,B的转化率为分别为___;A的体积分数为___。
(3)下列操作能使该反应的反应速率增大的是___。
A.向密闭容器中通入氦气增大压强
B.增大A的浓度
C.适当升高温度
D.将容器的体积扩大至10L
(4)反应过程中容器内气体的密度是___(填“增大”、“减小”或“不变”,下同),平均相对分子质量是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com