
����Ŀ����ҵ�Ͽ������̿�(��Ҫ�ɷ���MnO2)�ͻ�����(��Ҫ�ɷ���FeS2)Ϊ��Ҫԭ���Ʊ������ܴ��Բ���̼����(MnCO3)���乤���������£��� ��
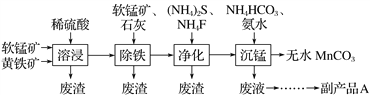
��֪�����������Ŀ���dz�ȥ��Һ�е�Ca2+��Cu2+�����ʣ�CaF2���ܣ���
����˵������ȷ����
A. ��ĥ��ʯ���ʵ������¶Ⱦ�������ܽ�������ԭ�ϵĽ�����
B. ���������У��ڼ���ʯ�ҵ�����Һ��pHǰ���������������̿����ķ�ӦΪMnO2��2Fe2����4H��===2Fe3����Mn2����2H2O
C. ����ƷA�Ļ�ѧʽ(NH4)2S
D. �ӳ��̹����еõ�����MnCO3�IJ��������ǹ��ˡ�ϴ�ӡ�����
���𰸡�C
�������������̿�֪���̿�(��Ҫ�ɷ�MnO2)�ͻ������������������˵õ�����Һ������ҺpH��FeS2��ϡ���ᷴӦ����Fe2+��Ȼ����˵õ�������MnO2������Һ�м������̿��������ӷ�Ӧ����ʽΪ��2Fe2++15MnO2+28H+=2Fe3++14H2O+15Mn2++4SO42�����ˣ���Һ����Ҫ����Cu2+��Ca2+�����ʣ�������狀ͷ����������CuS��CaF������ȥ������Һ�м���̼����狀Ͱ�ˮ���̣�����MnCO3���������˵õ�����������Ҫ����MnCO3��ͨ��ϴ�ӡ���ɵõ�MnCO3���塣A. ��߽�ȡ�ʵĴ�ʩ�����ǽ��衢�ʵ������¶ȡ���ĥ��ʯ���ʵ��������Ũ�ȵȣ���A��ȷ��B. ��Ҫ�ɷ���FeS2�Ļ���������������в����������ӣ�������̵ڶ����������ڵ���Ӧ��ת�������Ӳ��ܸ��ó�ȥ��������Ҫ�������������̿�ʹ�����Fe2+ת��ΪFe3+�����ӷ���ʽΪMnO2+2Fe2++4H+=2Fe3++Mn2++2H2O���ټ���ʯ�ҵ���pHֵʹFe3+��ȫ��������B��ȷ��C.�õ�����Һ�л��д�����笠����Ӻ����������û�з�Ӧ����˿����Ƶĸ���ƷΪ��(NH4)2SO4����C����D. �ӳ��̹����еõ�����MnCO3��ֻ�轫����������MnCO3���ˡ�ϴ�ӡ����T�ɣ���D��ȷ����ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�������Ҵ���Ũ������廯�Ʒ�Ӧ���Ʊ������飬�䷴Ӧԭ��ΪH2SO4(Ũ)��NaBr![]() NaHSO4��HBr����CH3CH2OH��HBr
NaHSO4��HBr����CH3CH2OH��HBr![]() CH3CH2Br��H2O���й����ݺ�ʵ��װ���磨��Ӧ��Ҫ���ȣ�ͼ��ʡȥ�˼���װ�ã���
CH3CH2Br��H2O���й����ݺ�ʵ��װ���磨��Ӧ��Ҫ���ȣ�ͼ��ʡȥ�˼���װ�ã���
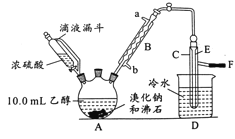
�Ҵ� | ������ | �� | |
״̬ | ��ɫ Һ�� | ��ɫ Һ�� | �����ɫ Һ�� |
�ܶ�/g��cm-3 | 0.79 | 1.44 | 3.1 |
�е�/�� | 78.5 | 38.4 | 59 |
��1��A�з����ʯ��������__��B�н�ˮ��Ϊ__�ڣ�����a������b������
��2��ʵ�����õ�Һ©�������Һ©�����ŵ�Ϊ__��
��3����������Ũ�����ϼ��ȷ���������ԭ��Ӧ�Ļ�ѧ����ʽ__��
��4����A���ȵ�Ŀ����__��F����Ƥ�ܵ���ϡNaOH��Һ����Ŀ��������__������������ֹ__��
��5��C�еĵ���E��ĩ������ˮ�����£���ԭ����__��
��6����C�е��ֳ�Һת���β�ƿ�У�������ε���ŨH2SO41��2mL�Գ�ȥˮ���Ҵ������ʣ�ʹ��Һ�ֲ���÷�Һ©����ȥ����㣻�������ᴦ�����������ת��������ƿ��ˮԡ���������ռ���35��40������Լ10.0g��
�ٷ�Һ©����ʹ��ǰ����__��
�ڴ��Ҵ��ĽǶȿ��ǣ���ʵ������������IJ�����__����ȷ��0.1%����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪: 25�桢101 kPa�£��� 2 Na(s) + 1/2 O2(g) = Na2O(s) ��H1 = - 414 kJ / mol
�� 2 Na(s) + O2(g) = Na2O2(s) ��H2 = - 511 kJ / mol
����˵����ȷ����
A. ������������������Ӹ����Ȳ����
B. ���������ɵ����ʵ����IJ��ת�Ƶ�������ͬ
C. ������Na������O2��Ӧ����Na2O�����¶���������Na2O�������ӿ�
D. 25�桢101 kPa�£�Na2O2(s) + 2 Na(s) = 2 Na2O(s) ��H = -317 kJ / mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���в���ȷ����
�ٳ�ȥ�����л��е���ϩ���Խ�����ͨ������KMnO4��Һ��
�ڳ����մ���ijһ�ٽ��¶��µ���Ϊ�㣬�����ڵ�������ͨ��ҽ�Ƶ�����
��úȼ��ʱ��������ʯ��ʯ���ɼ��ٷ�����SO2������
�ܿ����ü����Ȼ�粒��壬���ü�ʯ�ҳ�ȥ�Ȼ���ķ����ư�����
�ݸ߷��Ӳ����е��л�����Ӿ�����״�ṹ��
��ȥ������Һ�е�Ca2+��Mg2+��SO![]() ��������Һ�����μ������BaCl2��NaOH��Na2CO3��HCl��Һ���ٹ��ˡ�
��������Һ�����μ������BaCl2��NaOH��Na2CO3��HCl��Һ���ٹ��ˡ�
A.2��B.3��C.4��D.5��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ȷ��������
�� CO2��SO2��P2O5������������
��Ca(HCO3)2 ��Fe(OH)3��FeCl2�����ɻ��Ϸ�Ӧ�Ƶ�
�� �⾧���ɢ���ƾ��С���������ˮ�����γɵķ�ɢϵ�ֱ�Ϊ����Һ������
�� ���ȵ�̿��CO2�ķ�Ӧ��Ba(OH)2��8H2O��NH4Cl�ķ�Ӧ������������ԭ��Ӧ���������ȷ�Ӧ
�� ��Ҫͨ��ſɽ��е��У����롢��⡢��Ӿ����ơ��绯ѧ��ʴ
�� �Ȼ�����Һ����������������еĹ�ͬ�����ǣ�������ֽ���������ɡ����պ�������������
�� ���մ��������ǿ����ʡ�������ʺͷǵ����˳�����е���CuSO4��5H2O�����ᡢ���Լء������ᡢ����
�� ����Ԫ�غͷǽ���Ԫ���γɵĻ����ﲻһ�������ӻ�����
A. 3��B. 4��C. 5��D. 6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���AgNO3��Һ�ֱ�ζ�Ũ�Ⱦ�Ϊ0.0lmol/L��KCl��K2C2O4��Һ�����õij����ܽ�ƽ��ͼ����ͼ��ʾ(������C2O42-��ˮ��)����֪Ksp(AgC1)������Ϊ10-10��������������ȷ���ǣ� ��
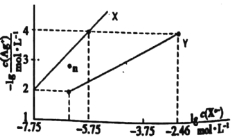
A.ͼ��Y�ߴ�����Ag2C2O4
B.n���ʾAgCl�Ĺ�������Һ
C.��c(Cl-)=c(C2O42-)�Ļ��Һ�е���AgNO3��Һʱ��������AgC1����
D.Ag2C2O4+2Cl-=2AgC1+C2O42-��ƽ�ⳣ��Ϊ1.0��10-0.7l
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����TiO2Ϊ�����Ĺ��Ȼ�ѧѭ���ֽ�CO2��ӦΪ������������ṩ��һ����;�����÷�Ӧ�Ļ����������ӻ�ѧ����ȫ����ʱ�������仯����ͼ��ʾ��
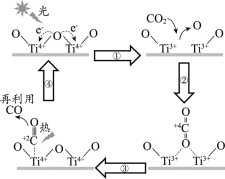
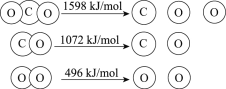
����˵����ȷ����
A.���̢������������ѻ��ͷ�����
B.�÷�Ӧ�У����ܺ�����ת��Ϊ��ѧ��
C.ʹ��TiO2���������Խ��ͷ�Ӧ���ʱ䣬�Ӷ����ѧ��Ӧ����
D.CO2�ֽⷴӦ���Ȼ�ѧ����ʽΪ2CO2(g) =2CO(g) + O2(g) ��H= + 30 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���A�ķ���ʽΪC4H8O2����֪A��E������ת����ϵ���£��Իش��������⣺

(1)C�еĹ�����������_______��
(2)E�Ľṹ��ʽ��_______��
(3)��ͼ�Т١��ܵķ�Ӧ�У�����������Ӧ����________��
(4)д����Ӧ�ڵĻ�ѧ����ʽ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����жԻ�ѧ�������������ȷ���ǣ� ��
A.ԭ�ӽṹʾ��ͼ��![]() ���Ա�ʾ35Cl��Ҳ���Ա�ʾ37Cl
���Ա�ʾ35Cl��Ҳ���Ա�ʾ37Cl
B.����ʽ��![]() ���Ա�ʾ�ǻ���Ҳ���Ա�ʾ����������
���Ա�ʾ�ǻ���Ҳ���Ա�ʾ����������
C.����ģ��![]() �����Ա�ʾ������ӣ�Ҳ���Ա�ʾ���Ȼ�̼����
�����Ա�ʾ������ӣ�Ҳ���Ա�ʾ���Ȼ�̼����
D.�ṹ��ʽ(CH3)2CHOH�����Ա�ʾ1-������Ҳ���Ա�ʾ2-����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com