
【题目】在一定温度下,向a L密闭容器中加入1 mol X气体和2 mol Y气体,发生如下反应:X(g)+2Y(g)![]() 2Z(g),不能说明此反应达到平衡的标志是( )
2Z(g),不能说明此反应达到平衡的标志是( )
A.容器内压强不随时间变化
B.容器内各物质的百分含量不随时间变化
C.容器内X、Y、Z的浓度之比为1:2:2
D.v正(X)=2v逆(Y)
【答案】CD
【解析】
A.该反应前后的化学计量数之和不相等,容器内的压强不随时间改变,能确定反应达到平衡状态,A不符合题意;
B.若反应未达到平衡,则任何一组分的物质的量都会发生变化,物质的百分含量也会发生变化,所以若容器内各物质的百分含量不随时间变化,说明反应达到平衡状态,B不符合题意;
C.当体系达到平衡状态时X、Y、Z的浓度之比可能为l:2:2,也不能不等于l:2:2,这取决于开始加入的物质的多少及反应条件和物质的转化率,与平衡状态无关,因此不能据此确定反应处于平衡状态,C符合题意;
D.在任何条件下都存在v正(Y)=2v正(X),若v正(X)=2v逆(Y),则v正(Y)=2v正(X)=4v逆(Y),反应正向进行,未达到平衡状态,D符合题意;
故合理选项是CD。


科目:高中化学 来源: 题型:
【题目】下列各组物质中,彼此之间关系正确的是
A. C(金刚石)与C(石墨)属于同位素
B. CH2=CH2和CH2=CH-CH=CH2属于同系物
C. CH3CH(CH3)2和CH4属于同系物
D. ![]() 与
与![]() 是同分异构体
是同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的有
①除去乙烷中混有的乙烯可以将气体通过足量KMnO4溶液;
②超导陶瓷在某一临界温度下电阻为零,可用于电力、交通、医疗等领域;
③煤燃烧时加入适量石灰石,可减少废气中SO2的量;
④可以用加热氯化铵固体,再用碱石灰除去氯化氢的方法制氨气;
⑤高分子材料中的有机物分子均呈链状结构;
⑥除去粗盐溶液中的Ca2+、Mg2+和SO![]() ,可向溶液中依次加入过量BaCl2、NaOH、Na2CO3和HCl溶液,再过滤。
,可向溶液中依次加入过量BaCl2、NaOH、Na2CO3和HCl溶液,再过滤。
A.2个B.3个C.4个D.5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.0lmol/L的KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O42-的水解)。已知Ksp(AgC1)数量级为10-10。下列叙述不正确的是( )
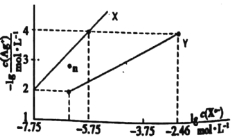
A.图中Y线代表的Ag2C2O4
B.n点表示AgCl的过饱和溶液
C.向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成AgC1沉淀
D.Ag2C2O4+2Cl-=2AgC1+C2O42-的平衡常数为1.0×10-0.7l
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如下图所示。
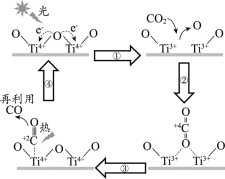
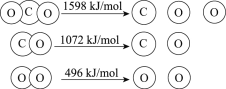
下列说法正确的是
A.过程①中钛氧键断裂会释放能量
B.该反应中,光能和热能转化为化学能
C.使用TiO2作催化剂可以降低反应的焓变,从而提高化学反应速率
D.CO2分解反应的热化学方程式为2CO2(g) =2CO(g) + O2(g) ΔH= + 30 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物的用途广泛,碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质。
(1)C60分子形成的晶体中,在晶胞的顶点和面心均含有一个C60分子,则一个C60晶胞的质量为____。
(2)干冰和冰是两种常见的分子晶体,下列关于两种晶体的比较中正确的是____。
a. 晶体的密度:干冰>冰 b. 晶体的熔点:干冰>冰
c. 晶体中的空间利用率:干冰>冰 d. 晶体中分子间相互作用力类型相同
(3)金刚石和石墨是碳元素形成的两种常见单质,下列关于这两种单质的叙述中正确的有____。
a. 金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化
b. 晶体中共价键的键长:金刚石中C-C<石墨中C-C
c. 晶体的熔点:金刚石>石墨
d. 晶体中共价键的键角:金刚石>石墨
e. 金刚石晶体中只存在共价键,石墨晶体中则存在共价键、金属键和范德华力
f. 金刚石和石墨的熔点都很高,所以金刚石和石墨都是原子晶体
(4)金刚石晶胞结构如图所示,立方BN结构与金刚石相似,在BN晶体中,B原子周围最近的N原子所构成的立体图形为____,一个晶胞中N原子数目为____。
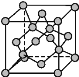
(5)碳与孔雀石共热可以得到金属铜,金属铜采用面心立方最密堆积,即在晶胞的顶点和面心均含有一个Cu原子,则Cu晶体中Cu原子的配位数为___。已知Cu晶体的密度为ρ g·cm-3,Cu的相对原子质量为M,阿伏加德罗常数为NA,则Cu的原子半径为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的分子式为C4H8O2,已知A~E有下列转化关系如下,试回答下列问题:

(1)C中的官能团名称是_______;
(2)E的结构简式是_______。
(3)在图中①~④的反应中,属于氧化反应的有________。
(4)写出反应②的化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里用下图所示装置制取纯净的无水![]() 。试回答下列问题:
。试回答下列问题:
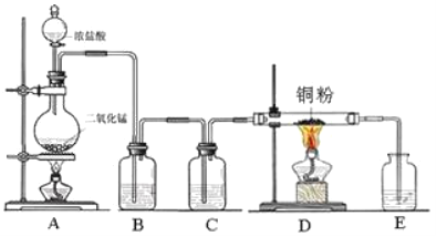
(1)写出烧瓶中发生反应的化学方程式,并用双线桥标出电子转移的方向和数目______________。
(2)B处盛有饱和食盐水的作用是______________。
(3)C处盛放的试剂__________(填名称),其作用是______________。
(4)E处盛有___________(填名称),其作用是______________,发生反应的离子方程式为___________________。
(5)实验开始时,应先点燃__________处(填字母,下同)酒精灯;实验结束时,应先熄灭__________处酒精灯。
(6)D处发生反应的化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,请用化学用语回答下列问题:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ⑥ | ⑦ | ⑧ | |||||
3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
4 | ② | ④ |
(1) 在③~⑦元素中,原子半径最大的是__________(填元素符号);
(2) ⑦元素的最高价氧化物对应的水化物与其氢化物能生成盐M,M中含有的化学键类型有________________________;
(3)写出元素①和⑧的单质在加热条件下反应生成的化合物的电子式:_____________。
(4) ③、⑤、⑦、⑧形成的离子,其半径由小到大的顺序是________(填离子符号)
(5) ①~⑨中元素最高价氧化物对应的水化物中酸性最强的是_____________(填物质化学式),呈两性的氢氧化物是_________(填物质化学式);该化合物与NaOH溶液反应的离子方程式为___________。
(6) 用电子式表示元素③与⑨形成化合物的过程_____________________________。
(7)写出工业冶炼⑤的化学方程式:_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com