
【题目】完成下反应的化学方程式或离子方程
(1)铝与氧化铁在高温下反应(铝热反应)______________;
(2)医学上,用(胃舒平)氢氧化铝治疗胃酸过多,写出反应的离子方程式____________;
(3)工业上用焦炭和二氧化硅反应制得粗硅(Si)______________;
(4)苯的硝化反应______________;
(5)乙醇和钠反应______________。
科目:高中化学 来源: 题型:
【题目】实验室用乙醇制取乙烯,用电石(主要成分为CaC2,含少量CaS)制取乙炔。
(1)实验室制取乙烯的化学方程式为_____________________________,可用于制取乙烯的发生装置是_______。(选填编号)

a b c d
(2)制备乙烯气体时,常因温度过高而观察到溶液变黑,同时能闻到有刺激性气味的气体生成。在乙烯气体的制备过程中,浓硫酸没有体现的性质是________。
a 吸水性 b 脱水性 c 强氧化性 d 酸性
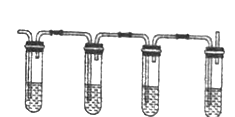
① ② ③ ④
有同学设计下列实验确认上述混合气体中有乙烯和二氧化硫。
上图中①、②、③、④装置盛放的试剂分别是(根据需要进行选择,填标号):
①_______________,②_______________,③_______________,④______________。
A 品红溶液 B NaOH溶液 C 浓硫酸 D 酸性高锰酸钾溶液
(3)实验室制备乙炔的化学反应方程式为_________________________________。实验室制乙炔时为避免电石和水反应过于激烈,除用分液漏斗控制滴速外,通常还可用_________代替水。为除去乙炔中混有的少量硫化氢杂质,可将气体通过___________(选填编号)。
a酸性KMnO4溶液 b CCl4 c NaOH溶液 d CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外兴趣小组为探究铜与浓硫酸的反应,用下图所示装置时行实验:
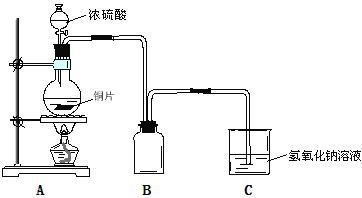

(1)B是用来收集实验中产生的气体的装置,装置图补充完整后正确的是__________;

(2)实验中他们取6.4g铜片和12mL 18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组中的同学认为还有一定量的硫酸剩余。
① 请写出铜跟浓硫酸反应的化学方程式:_____________________________________。
②下列试剂中,能证明反应停止后烧瓶中有硫酸剩余的是___________(填写字母编号)。
A.硫酸钠溶液 | B.BaCl2溶液 | C.银粉 | D.Na2CO3溶液 |
③为什么有一定量的硫酸剩余但未能使铜片完全溶解?你认为原因是__________________________。
(3)为了确定反应生成的主要气体成分,还可以在实验装置A和B之间补充以上右图D装置,其中洗气瓶中可以盛有__________(试剂)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。如图表示N2O在Pt2O+表面与CO反应转化成无害气体的过程。下列说法正确的是
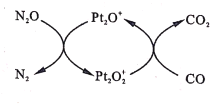
A.N2O转化成无害气体时的催化剂是Pt2O2+
B.每1mol Pt2O+转化为Pt2O2+得电子数为3NA
C.将生成的CO2通人含大量SiO32-、Na+、Cl-的溶液中,无明显现象
D.1g CO2 、N2O的混合气体中含有电子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质的电子式:
(1)CaCl2:___;Na2S:___;HCl:___。
写出下列物质的结构式:
(2)HClO:___;CO2:___;N2:___。
写出下列物质的结构示意图:
(3)Ca:___;Mg2+:___;F-:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应由两步反应A![]() B
B![]() C构成,反应过程中的能量变化曲线如图(E1、E3表示两反应的活化能)。下列有关叙述正确的是( )
C构成,反应过程中的能量变化曲线如图(E1、E3表示两反应的活化能)。下列有关叙述正确的是( )

![]()
A. 两步反应均为吸热反应 B. 三种化合物的稳定性顺序:B﹤A﹤C
C. 加入催化剂不改变反应的焓变,但能提高转化率 D. 整个反应的ΔH=E1-E2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物W 在工业上常用作溶剂和香料,其合成方法如下:
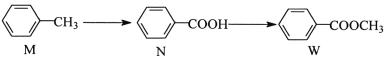
下列说法正确的是( )
A. M、N、W 均能发生加成反应、取代反应
B. N、W 组成上相差一个CH2原子团,所以互为同系物
C. W 属于酯类,酸性水解和碱性水解产物相同
D. 1mol N可与4mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | M层上有6个电子 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
W | 其单质既能跟酸反应,又能跟碱反应,都产生H2 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是___。
(2)元素Y与氢元素形成一种离子YH![]() ,写出该微粒的化学式:___(用元素符号表示).
,写出该微粒的化学式:___(用元素符号表示).
(3)元素Z与元素T相比,非金属性较强的是___(用元素符号表示),下列表述中能证明这一事实的是___。
①常温下Z的单质和T的单质状态不同
②Z的氢化物比T的氢化物稳定
③一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种的是___(填化学式),理由是_____ ;Z的最高价氧化物对应的水化物与W的最高价氧化物对应的水化物反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组探究SO2和Fe(NO3)3溶液的反应原理,实验装置如图所示。实验中B装置内产生白色沉淀。
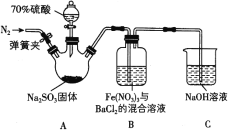
请回答下列问题:
(1)该实验过程中通入N2的时机及作用____。
(2)针对B装置内产生白色沉淀的原因,甲同学认为是酸性条件下SO2与Fe3+反应的结果,乙同学认为是酸性条件下SO2与NO3-反应的结果。请就B装置内的上清液,设计一个简单的实验方案检验甲同学的猜想是否正确:____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com