
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | M层上有6个电子 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
W | 其单质既能跟酸反应,又能跟碱反应,都产生H2 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是___。
(2)元素Y与氢元素形成一种离子YH![]() ,写出该微粒的化学式:___(用元素符号表示).
,写出该微粒的化学式:___(用元素符号表示).
(3)元素Z与元素T相比,非金属性较强的是___(用元素符号表示),下列表述中能证明这一事实的是___。
①常温下Z的单质和T的单质状态不同
②Z的氢化物比T的氢化物稳定
③一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种的是___(填化学式),理由是_____ ;Z的最高价氧化物对应的水化物与W的最高价氧化物对应的水化物反应的离子方程式为___。
【答案】![]() C NH
C NH![]() Cl ② H2CO3 为弱酸,其它三种为强酸 3H++Al(OH)3═Al3++3H2O
Cl ② H2CO3 为弱酸,其它三种为强酸 3H++Al(OH)3═Al3++3H2O
【解析】
短周期元素,T元素原子M层上有6个电子,则T为S元素;X元素原子最外层电子数是次外层电子数的2倍,则X原子只能有2个电子层,最外层电子数为4,则X为C元素;常温下Y元素单质为双原子分子,其氢化物水溶液呈碱性,则Y为N元素;Z元素最高正价是+7价,则Z为Cl元素;W单质既能跟酸反应,又能跟强碱反应,都产生H2,则W为Al元素,以此分析解答本题。
(1)根据上述分析可知:X为C元素,C元素中的同位素![]() C可测定文物年代;
C可测定文物年代;
故答案:![]() C;
C;
(2)根据上述分析可知:Y为N元素,N元素与氢元素形成一种离子为NH![]() ,则该微粒的化学式为NH
,则该微粒的化学式为NH![]() ;
;
故答案:NH![]() ;
;
(3)根据上述分析可知:T为S元素,Z为Cl元素,元素Z与元素T在同一周期且原子序数逐渐增大,所以非金属性S<Cl。
①物理性质不同,不能说明非金属性强弱,故①错误;
②氢化物越稳定,中心元素的非金属性越强,故②正确;
③与氢氧化钠溶液反应不能说明非金属性强弱,如氧气不能与氢氧化钠溶液反应,非金属性O>S,故③错误;
故答案为:Cl;②;
(4)T、X、Y、Z四种元素的最高价氧化物对应水化物分别为H2SO4、H2CO3、HNO3、HClO4,H2CO3是弱酸,其余均为强酸,Z的最高价氧化物的水化物高氯酸为强酸,W的最高价氧化物的水化物氢氧化铝为弱碱,两者反应的离子方程式为:3H++Al(OH)3=Al3++3H2O;
故答案为:H2CO3;H2CO3是弱酸,其余均为强酸;3H++Al(OH)3=Al3++3H2O;


科目:高中化学 来源: 题型:
【题目】下列正确的叙述有
① CO2、SO2、P2O5均为酸性氧化物
②Ca(HCO3)2 、Fe(OH)3、FeCl2均可由化合反应制得
③ 碘晶体分散到酒精中、淀粉溶于水中所形成的分散系分别为:溶液、胶体
④ 灼热的炭与CO2的反应、Ba(OH)2·8H2O与NH4Cl的反应均属于氧化还原反应,又是吸热反应
⑤ 需要通电才可进行的有:电离、电解、电泳、电镀、电化学腐蚀
⑥ 氯化铁溶液与氢氧化铁胶体具有的共同性质是:能透过滤纸,加热蒸干、灼烧后都有氧化铁生成
⑦ 按照纯净物、混合物、强电解质、弱电解质和非电解质顺序排列的是CuSO4·5H2O、盐酸、苛性钾、次氯酸、氨气
⑧ 金属元素和非金属元素形成的化合物不一定是离子化合物
A. 3个B. 4个C. 5个D. 6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下反应的化学方程式或离子方程
(1)铝与氧化铁在高温下反应(铝热反应)______________;
(2)医学上,用(胃舒平)氢氧化铝治疗胃酸过多,写出反应的离子方程式____________;
(3)工业上用焦炭和二氧化硅反应制得粗硅(Si)______________;
(4)苯的硝化反应______________;
(5)乙醇和钠反应______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是一种用途广泛的精细化工产品。工业生产乙酸乙酯的方法很多,如图:

下列说法正确的是
A. 反应①、②均是取代反应
B. 反应③、④的原子利用率均为100%
C. 与乙酸乙酯互为同分异构体的酯类化合物有2种
D. 乙醇、乙酸、乙酸乙酯三种无色液体可用Na2CO3溶液鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组以甲苯为原料,合成抗癌药——拉帕替尼的中间体H的具体路线如下:
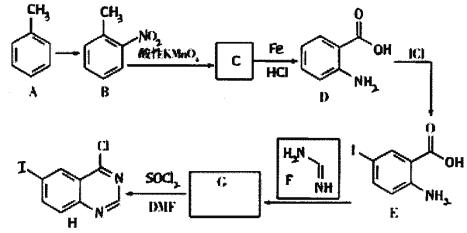
已知:①G的分子式为:C8H5N2OI
② ![]()
③![]()
回答下列问题:
(1)A→B的试剂和条件是__________;D→E的反应类型是________。
(2)C的结构简式为__________,其中含有的官能团名称为_____________。
(3)写出E→G反应的化学方程式________________。
(4)C有多种同分异构体,其中满足下列条件的同分异构体共有________种。①分子中含有苯环;②分子中含有—NO2且不含—O—NO2结构;③能发生银镜反应,其中核磁共振氢谱有3组峰,并且峰面积为1∶2∶2的有机物结构简式为____________。
(5)以硝基苯和有机物A为原料,设计路线合成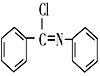 ,其他无机材料自选。___________。
,其他无机材料自选。___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学用语的理解中正确的是( )
A.原子结构示意图:![]() 可以表示35Cl,也可以表示37Cl
可以表示35Cl,也可以表示37Cl
B.电子式:![]() 可以表示羟基,也可以表示氢氧根离子
可以表示羟基,也可以表示氢氧根离子
C.比例模型![]() :可以表示甲烷分子,也可以表示四氯化碳分子
:可以表示甲烷分子,也可以表示四氯化碳分子
D.结构简式(CH3)2CHOH:可以表示1-丙醇,也可以表示2-丙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期元素在周期表中的位置如图所示。若X的最高正价与负价的代数和为2,则下列说法不正确是( )
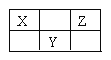
A.最简单气态氢化物稳定性Z>X
B.Z无氧酸溶液能在玻璃容器上刻标记
C.X的氢化物可用作制冷剂
D.原子半径由大到小为Y>Z>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应S2O82-(aq)+2I-(aq)![]() 2SO42-(aq)+I2(aq),若往该溶液中加人含Fe3+的某溶液,反应机理:①2Fe3++(aq)+2I-(aq)
2SO42-(aq)+I2(aq),若往该溶液中加人含Fe3+的某溶液,反应机理:①2Fe3++(aq)+2I-(aq)![]() I2(aq)+2Fe2+(aq)②2Fe2+(aq)+S2O82-(aq)
I2(aq)+2Fe2+(aq)②2Fe2+(aq)+S2O82-(aq) ![]() 2Fe3+(aq)+2SO42-(aq),下列有关该反应的说法不正确的是
2Fe3+(aq)+2SO42-(aq),下列有关该反应的说法不正确的是
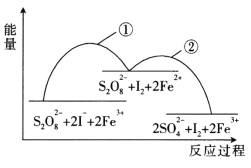
A.增大S2O82-浓度或I-浓度,反应①、反应②的反应速率均加快
B.Fe3+是该反应的催化剂
C.因为正反应的活化能比逆反应的活化能小,所以该反应是放热反应
D.往该溶液中滴加淀粉溶液,溶液变蓝,适当升温,蓝色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中正确的数目是
①12.0g熔融的NaHSO4中含有的阳离子数为0.2NA
②1mol Na2O 和Na2O2混合物中含有的阴、阳离子总数是3NA
③常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
④7.8g![]() 中含有的碳碳双键数目为0.3NA
中含有的碳碳双键数目为0.3NA
⑤用1L1.0 mol/LFeCl3溶液制备氢氧化铁胶体,所得氢氧化铁胶粒的数目为NA
⑥1mol SO2与足量O2在一定条件下充分反应生成SO3,共转移2NA个电子
⑦在反应KIO3+6HI=KI+3I2 +3H2O 中,每生成3molI2转移的电子数为5NA
⑧常温常压下,17 g甲基(-14CH3)中所含的中子数为9NA
A.3B.4C.5D.6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com