
����Ŀ���ҹ������ƾõ���ʷ,����������ʪ����ͭ(Fe��CuSO4��Cu��FeSO4)���Իش��������}��
(1)Cu2+��δ�ɶԵ�������_____����H��O��S�縺���ɴ�С��˳��Ϊ______________________��
(2)��֪[Cu(NH3)4]SO4��һ������
��[Cu(NH3)4]SO4�л�ѧ��������______________��[Cu(NH3)4]2���Ľṹ��ʽΪ_________________������������ԭ���ӻ�����Ϊ____________________��
��NH3��H2O��HF�ķе��ɸߵ���Ϊ_________________��
(3)��ͭ�Ͻ�������Ϊ________________�����ĵ���(I3)�͵���(I4)�����ֱܷ�Ϊ2957 kJ/mol��5290 kJ/mol���Ƚ����ݲ�����ԭ��________________��
(4)��ͭ�Ͻ��һ�־���ṹΪ�������ͣ���ͼ��ʾ��
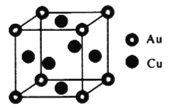
�ٸúϽ�Ļ�ѧʽΪ_______________��
����֪�úϽ���ܶ�Ϊd g/cm3�������ӏ�����ֵΪNA����þ������ⳤΪ__________nm��
���𰸡�1 O��S��H ���ۼ�����λ�������Ӽ� 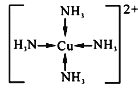 sp3�ӻ� H2O��HF��NH3 �������� ��̬��ԭ�ӵļ۵����Ų�ʽΪ3d64s2��ʧȥ3�����Ӻ������ӳʰ�����ȶ�״̬�����I4Զ����I3 AuCu3��Cu3Au
sp3�ӻ� H2O��HF��NH3 �������� ��̬��ԭ�ӵļ۵����Ų�ʽΪ3d64s2��ʧȥ3�����Ӻ������ӳʰ�����ȶ�״̬�����I4Զ����I3 AuCu3��Cu3Au 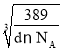 ��107
��107
��������
Cu��29��Ԫ�أ�Cuԭ��ʧȥ�����1��4s���Ӻʹ�����1��3d�����γ�Cu2+�����ݹ���ԭ���ɵ�Cu2+�ĺ�������Ų�ʽ��Ԫ�صķǽ�����Խǿ�縺��Խ��
(2)��[Cu(NH3)4]SO4��[Cu(NH3)4]2+��SO42-�γ����Ӽ���[Cu(NH3)4]2+��ͭ�����백����֮���γ���λ������������Nԭ����Hԭ��֮���γɹ��ۼ����ȼ���SO42-����ԭ��S�ŵ��Ӷ������ӻ������Ŀ��Ȼ�����ü۲���Ӷ���Ŀ�жϣ�
�ڷ���֮���γ������ʹ��е����ߣ�
(3)��ͭ�Ͻ������ڽ������壻Feԭ��ʧȥ3�������γ�3d5������ȶ��ṹ����ʧȥ1��������Ҫ�������϶ࣻ
(4)�پ�̯�����㾧����Au��Cuԭ����Ŀ��ȷ����ѧʽ��
�ڸ��ݾ����к��еĸ���Ԫ�ص�ԭ�Ӹ������㾧���������ٸ�����=![]() ���㣬��������
���㣬��������
(1)Cu2+�ĺ�������Ų�ʽΪ1s22s22p63s23p63d9��3d�������1��δ�ɶԵ��ӣ�������Ӿ��γ��˵��Ӷԣ����Cu2+����ֻ��1��δ�ɶԵ��ӣ�Ԫ�صķǽ�����Խǿ����縺��Խ������Ԫ�صķǽ����ԣ�O��S��H����Ԫ�صĵ縺���ɴ�С˳��Ϊ��O��S��H��
(2)��[Cu(NH3)4]SO4��[Cu(NH3)4]2+��SO42-�γ����Ӽ���[Cu(NH3)4]2+��ͭ�����백����֮���γ���λ������������Nԭ����Hԭ��֮���γɹ��ۼ�������[Cu(NH3)4]SO4�к��еĻ�ѧ������Ϊ���Ӽ������ۼ�����λ����[Cu(NH3)4]2+�Ľṹ��ʽΪ��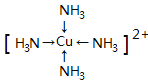 ��
��
SO42-����ԭ��S�ŵ��Ӷ���=![]() =0���ӻ������Ŀ=0+4=4������Sԭ�Ӳ�ȡsp3�ӻ���
=0���ӻ������Ŀ=0+4=4������Sԭ�Ӳ�ȡsp3�ӻ���
��NH3��H2O��HF����֮�䶼�������������IJ����������˷���֮�����������ʹ�����۷е����ߡ�����H2O����֮�������Ŀ�ࡢ���ǿ�����۷е���ߣ�HF����֮��������NH3���Ӽ�����ǿ����NH3��H2O��HF�ķе��ɸߵ���Ϊ��H2O��HF��NH3��
(3)��ͭ�Ͻ������ڽ������壻Fe��26��Ԫ�أ���̬��ԭ�ӵļ۵����Ų�ʽΪ3d64s2��Fe�ĵ�����������ʧȥ3d6��1��������Ҫ�������������ĵ�������ʧȥ3d5��1��������Ҫ������������3d5Ϊ������ȶ��ṹ����ʧȥ1��������Ҫ�������϶࣬�����ĵ���(I4)������Զ���ڵ���(I3)�����ܣ�
(4)�پ�����Auԭ����Ŀ=8��![]() =1��Cuԭ����Ŀ=6��
=1��Cuԭ����Ŀ=6��![]() =3���ʻ�ѧʽΪAuCu3��дΪCu3Au��
=3���ʻ�ѧʽΪAuCu3��дΪCu3Au��
�ھ�������m=![]() g�������ܶ�Ϊd g/cm3��������L=
g�������ܶ�Ϊd g/cm3��������L=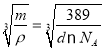 cm=
cm=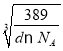 ��107 nm��
��107 nm��


 ���ɶ��ȫ���ƿؾ�ϵ�д�
���ɶ��ȫ���ƿؾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ʱ�������г������ɣ�����˵������ȷ����![]()
A.![]() ��
��![]() ���ת���������仯
���ת���������仯
B.![]() ��
��![]() ��Ϊͬ������
��Ϊͬ������
C.�����ʵ�����![]() ��
��![]() ���е�����������ͬ
���е�����������ͬ
D.����ͬ���¶���ѹǿ�£��������![]() ��
��![]() ������ͬ�ķ�����
������ͬ�ķ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������س���������ɱ����ˮ�ʾ������ȡ�ijС�������̿�(��Ҫ��MnO2,����������SiO2��Al2O3��Fe2O3������)ģ�ҵ�Ƹ�������������¡��Իش��������⡣
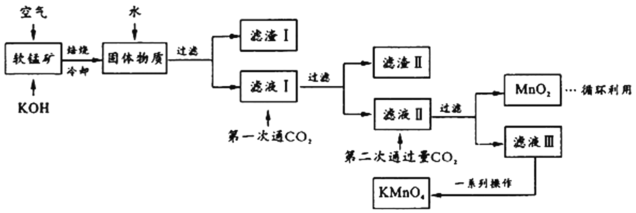
(1)��ƽ����ʱ��ѧ��Ӧ��________MnO2��________��________O2![]() ________K2MnO4��________H2O����ҵ�����в��öԿ�����ѹ�ķ������MnO2�����ʣ�������ײ���۽�����ԭ��___________________________��
________K2MnO4��________H2O����ҵ�����в��öԿ�����ѹ�ķ������MnO2�����ʣ�������ײ���۽�����ԭ��___________________________��
(2)������ijɷ���_________(��ѧʽ)����һ��ͨCO2������ϡ��������ԭ����_____________��
(3)�ڶ���ͨ�����CO2����MnO2�����ӷ���ʽΪ________________________��
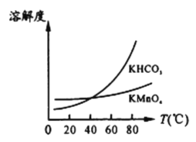
(4)����Һ�����һϵ�в�����KMnO4��
��ͼ��֪������Һ��õ�KMnO4�辭��__________��___________��ϴ�ӵȲ�����
(5)��ҵ�ϰ���������������������MnO2 a%�����̿�1�֣�������������KMnO4____________�֡���������С�������λ��
(6)���õ�ⷨ�ɵõ�������KMnO4�ö��Ե缫�����Һ��
�ٵ���������ӦʽΪ________________________________��
�������������������������������____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2��CH4���Ƶúϳ�����CH4(g)��CO2(g)2CO(g)��2H2(g) ��H=+247 kJ��mol��1����ʼ�¶Ⱦ�ΪT Kʱ����3�������а���ͬ��ʽͶ�뷴Ӧ�����������Ӧ�������Ϣ���±���
���� | ��ʼ���ʵ���/mol | CO2ƽ��ת����(��) | |||||
��� | �ݻ�/L | ���� | CH4(g) | CO2(g) | CO(g) | H2(g) | |
�� | 2 | ���º��� | 2 | 1 | 0 | 0 | 50% |
�� | 1 | 0.5 | 1 | 0 | 0 | ||
�� | 1 | ���Ⱥ��� | 1 | 0.5 | 0 | 0 | �� |
����˵����ȷ����
A.T Kʱ����ӦCH4(g)��CO2(g)2CO(g)��2H2(g)��ƽ�ⳣ��Ϊ1/3
B.�������з�Ӧ�ﵽƽ��ʱ����(CO2����)=50%
C.�������з�Ӧ�ﵽƽ��ʱ��Ӧ����123.5��247 kJ��mol��1��Χ��
D.�������з�Ӧ�ﵽƽ��ʱ����Ͷ��0.5 mol CH4��0.25 mol CO����Ӧ�ﵽ��ƽ��ǰ��v(��)<v(��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��.�����£�Ũ�Ⱦ�Ϊ0.1 mol��L��1��������Һ��pH���±���ʾ��

��ش��������⣺
(1)����������Һ�У�ˮ�ĵ���̶���С����_____(�ѧʽ)��
(2)����������ˮ�д������Ũ�ȣ�������ˮ�м����ϱ��е�������_____(��дһ�����ʼ���)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2C2O4Ϊ��Ԫ������Ka1 (H2C2O4 ) =5.4��102��Ka2 (H2C2O4 ) =5.4��105����H2C2O4��Һ��c(��)=c(H2C2O4) +c(HC2O4) +c(C2O42)����������NaOH��Һ�ζ�25.00 mL 0.1000 mol��L1H2C2O4��Һ���յ㡣�ζ����̵õ���������Һ���������ʵ���Ũ�ȹ�ϵһ����ȷ����
A. 0.1000 mol��L1 H2C2O4��Һ��c(H+ ) =0.1000 mol��L1+c(C2O42 )+c(OH)c(H2C2O4 )
B. c(Na+ ) =c(��)����Һ��c(Na+ ) >c(H2C2O4 ) >c(C2O42 ) >c(H+ )
C. pH = 7����Һ��c(Na+ ) =0.1000 mol��L1+ c(C2O42) c(H2C2O4)
D. c(Na+ ) =2c(��)����Һ��c(OH) c(H+) = 2c(H2C2O4) +c(HC2O4)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Cl2��NaOH��(NH2)2CO�����أ���SO2Ϊԭ�Ͽ��Ʊ�N2H4��H2O��ˮ���£�����ˮNa2SO3������Ҫʵ���������£�

��֪����Cl2+2OH![]() ClO+Cl+H2O�Ƿ��ȷ�Ӧ��
ClO+Cl+H2O�Ƿ��ȷ�Ӧ��
��N2H4��H2O�е�Լ118 �棬����ǿ��ԭ�ԣ�����NaClO���ҷ�Ӧ����N2��
��1��������Ʊ�NaClO��Һʱ�����¶ȳ���40 ����Cl2��NaOH��Һ��Ӧ����NaClO3��NaCl�������ӷ���ʽΪ____________________________________��ʵ���п����¶ȳ��ñ�ˮԡ�⣬�����ȡ�Ĵ�ʩ��____________________________________��
��2�������ϳ�N2H4��H2O��װ������19ͼ1��ʾ��NaClO������Һ������ˮ��Һ��40 �����·�Ӧһ��ʱ�����Ѹ��������110 �������Ӧ��ʵ����ͨ����Һ©���μӵ���Һ��_____________��ʹ�������ܵ�Ŀ����_________________________________��

��3��������ò����õ��ĸ���ƷNa2CO3�Ʊ���ˮNa2SO3��ˮ��Һ��H2SO3��![]() ��
��![]() ��pH�ķֲ�����19ͼ2��ʾ��Na2SO3���ܽ����������19ͼ3��ʾ����
��pH�ķֲ�����19ͼ2��ʾ��Na2SO3���ܽ����������19ͼ3��ʾ����

�ٱ߽������Na2CO3��Һ��ͨ��SO2�Ʊ�NaHSO3��Һ��ʵ����ȷ����ʱֹͣͨSO2��ʵ�����Ϊ_________________��
���벹��������NaHSO3��Һ�Ʊ���ˮNa2SO3��ʵ�鷽���� _______________________����������ˮ�Ҵ�ϴ�ӣ�����ܷ��װ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����V L NH3(������ɱ�״����)ͨ��1 Lˮ�У��γ��ܶ�Ϊ�� g��cm-3�İ�ˮ����������Ϊw�����к�NH3�����ʵ���Ϊa mol������˵����ȷ����
A.���ʵ����ʵ���Ũ��c =![]() mol��L-1
mol��L-1
B.���ʵ��������� w=![]() ��100%
��100%
C.��Һ��c(OH-)= amol��L-1
D.������Һ����ͨ����ԭ��Һ�������ˮ��������Һ��������������0.5w
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ش��������⣺
��1��﮺�þ��Ԫ�����ڱ������������Խ�������ϵ�����ǵ��������ơ������й�﮼��仯�������������ȷ����___��
A.Li2SO4������ˮ
B.Li��N2��Ӧ������Li3N
C.LiOH������ˮ
D.LiOH��Li2CO3���ȶ��ֽ�
��2������λ�ڶԽ���λ�õĵڶ�����Ԫ����Be��������Be(OH)2��Mg(OH)2��һ���Լ���___����Ӧ�����ӷ���ʽΪ___��
��3���Ž��з����о�Ԫ�����ڱ�ʱ����ѧ��Ԥ����11����δ���ֵ�Ԫ�أ�Ϊ���������ڱ������¿�λ�����磬��Ԥ���������·���һ���������Ƶ�Ԫ������������������������ѧ����1875�귢�֣�����Ϊ�ء��������ڱ��е�λ����___��
��4����������ͬ����ĵ�������Ԫ�����ʵ��Ʋ��в���ȷ����___��
A.����������ɫ�����Ľ���
B.������������������������
C.�ڻ��������ԣ�3��
D.����������ķ�Ӧ��������
��5��д������������Ԫ����ԭ�Ӱ뾶����ԭ�ӵĵ����ڿ����м��������·�Ӧ����ĵ���ʽ___��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com