
【题目】根据下列图示所得出的结论正确的是
A. 是Ba(OH)2溶液中滴加NaHSO4溶液之后,溶液的导电能力随滴入NaHSO4溶液体积变化的曲线,说明a点对应的溶液呈碱性
是Ba(OH)2溶液中滴加NaHSO4溶液之后,溶液的导电能力随滴入NaHSO4溶液体积变化的曲线,说明a点对应的溶液呈碱性
B. 表示某放热反应分别在有、无催化剂的情况下,反应过程中的能量变化
表示某放热反应分别在有、无催化剂的情况下,反应过程中的能量变化
C. 是I2+I-I3-中I3-的平衡浓度随温度变化的曲线,说明平衡常数K(T1)<K(T2)
是I2+I-I3-中I3-的平衡浓度随温度变化的曲线,说明平衡常数K(T1)<K(T2)
D. 是室温下用0.1 mol·L-1 NaOH溶液滴定0.1 mol·L-1某酸HX的滴定曲线,说明可用甲基橙判断该反应的终点
是室温下用0.1 mol·L-1 NaOH溶液滴定0.1 mol·L-1某酸HX的滴定曲线,说明可用甲基橙判断该反应的终点
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】已知碳化铝(Al4C3)与水反应生成氢氧化铝和甲烷。为了探究甲烷性质,某同学设计如下两组实验方案:
甲:方案探究甲烷与氧化剂反应(如图1所示);
乙:方案探究甲烷与氯气反应的条件(如图2所示)。


甲方案实验现象:溴水不褪色,无水硫酸铜变蓝色,澄清石灰水变浑浊。
乙方案实验操作过程:通过排饱和食盐水的方法收集两瓶甲烷与氯气(体积比为1:4)的混合气体,I瓶放在光亮处,II瓶用预先准备好的黑色纸套套上,按图2安装好装置,并加紧弹簧夹a和b。
(1)碳化铝与稀硫酸反应的化学方程式为__________。
(2)实验甲中浓硫酸的作用是 ______,集气瓶中收集到的气体 ____(填“能”或“不能”)直接排入空气中。
(3)下列对甲方案实验中的有关现象与结论的叙述都正确的是________(填标号)。
A.酸性高锰酸钾溶液不褪色,结论是通常条件下甲烷不能与强氧化剂反应
B.硬质玻璃管里黑色粉末无颜色变化,结论是甲烷不与氧化铜反应
C.硬质玻璃管里黑色粉末变红色,推断氧化铜与甲烷反应只生成水和二氧化碳
D.甲烷不能与溴水反应,推知甲烷不能与卤素单质反应
(4)写出甲方案实验中硬质玻璃管里可能发生反应的化学方程式:___(假设消耗甲烷与氧化铜的物质的量之比为2:7)
(5)—段时间后,观察到图2装置中出现的实验现象是 ________;然后打开弹簧夹a、b,现察到的实验现象是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性无色溶液中可能含下表中的若干种离子。
阳离子 | Mg2+、NH |
阴离子 | SiO |
实验I:取少量该溶液进行如图实验。
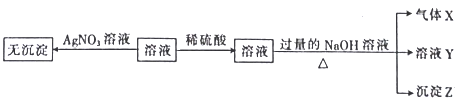
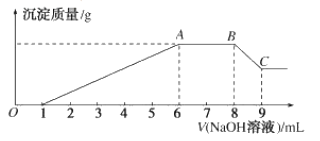
实验II:为了进一步确定该溶液的组成,取200mL原溶液,向该溶液中滴加2molL-1的NaOH溶液,产生沉淀的质量与氢氧化钠溶液体积的关系如图所示。
回答下列问题:
(1)不进行实验就可以推断出,上表中的离子一定不存在的有___种。
(2)通过实验I可以确定该溶液中一定存在的阴离子是___。
(3)写出实验II的图像中BC段对应的离子方程式:___。
(4)A点对应的固体质量为___ g。
(5)该溶液中阴离子的浓度为___ molL-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述一定正确的是( )
A.2.0gH218O和D2O的混合物中含有质子数为NA
B.1.0L 2.0 mol/L NaOH溶液中含有氧原子数为2NA
C.3.4gH2O2参加氧化还原反应时转移电子数一定为0.1NA
D.常温下,1mol的NaHSO4晶体中含阳离子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠的用途很广,可用做冶金、纺织、漂染等工业的基本原料.请根据题意回答下列问题:
Ⅰ![]() 世界最早工业生产碳酸钠的方法是路布兰
世界最早工业生产碳酸钠的方法是路布兰![]() 法.其流程如下:
法.其流程如下:

![]() 流程I的另一产物是 ______ ,流程Ⅱ的反应分步进行:
流程I的另一产物是 ______ ,流程Ⅱ的反应分步进行:![]()

![]() ;
;
![]() 与石灰石发生复分解反应,总反应方程式可表示为 ______ .
与石灰石发生复分解反应,总反应方程式可表示为 ______ .
Ⅱ![]() 年,比利时人索尔维
年,比利时人索尔维![]()
![]() 用氨碱法生产碳酸钠.反应原理如下:
用氨碱法生产碳酸钠.反应原理如下:

![]() 时一些物质在水中的溶解度
时一些物质在水中的溶解度![]()
NaCl |
|
|
|
|
|
|
|
|
|
![]() 氨碱法生成纯碱的原料是 ______ ,可循环利用的物质有 ______ .
氨碱法生成纯碱的原料是 ______ ,可循环利用的物质有 ______ .
![]() 饱和NaCl溶液通
饱和NaCl溶液通![]() 和
和![]() 能生成
能生成![]() 的原因有: ______ .
的原因有: ______ .
Ⅲ![]() 我国化工专家侯德榜研究出联合制碱法,其反应原理和氨碱法类似,但将制氨和制碱联合,提高了原料利用率.
我国化工专家侯德榜研究出联合制碱法,其反应原理和氨碱法类似,但将制氨和制碱联合,提高了原料利用率.

![]() 生产中需向分离出
生产中需向分离出![]() 后所得的溶液中加入NaCl固体并通入
后所得的溶液中加入NaCl固体并通入![]() ,在 ______
,在 ______ ![]() 填温度范围
填温度范围![]() 下析出 ______
下析出 ______ ![]() 填化学式
填化学式![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.常温下,浓度均为0.1 mol·L-1的六种溶液的pH如下表所示:

请回答下列问题:
(1)上述六种溶液中,水的电离程度最小的是_____(填化学式)。
(2)若欲增大氯水中次氯酸的浓度,可向氯水中加入上表中的物质是_____(填写一种物质即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】功能高分子P的合成路线如下:

(1)A的分子式是C7H8,其结构简式是________________________。
(2)试剂a是____________________。
(3)反应③的化学方程式:_________________________________________________。
(4)E的分子式是C6H10O2。E中含有的官能团:_________________________。
(5)反应④的反应类型是____________________________。
(6)反应⑤的化学方程式:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】干燥的二氧化碳和氮气反应可生成氨基甲酸铵固体,化学方程式为:2NH3(g)+CO2(g)![]() NH2COONH4(s)
NH2COONH4(s)![]() 在四氯化碳中通入二氧化碳和氨制备氨基甲酸铵的实验装置如图所示,回答下列问题:
在四氯化碳中通入二氧化碳和氨制备氨基甲酸铵的实验装置如图所示,回答下列问题:
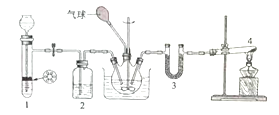
(1)装置1用来制备二氧化碳气体:将块状石灰石放置在试管中的带孔塑料板上,漏斗中所加试剂为____:装置2中所加试剂为____;
(2)装置4中试剂为固体NH4Cl和Ca(OH)2:发生反应的化学方程式为________;试管口不能向上倾斜的原因是__________。装置3中试剂为KOH,其作用为______________。
(3)反应时三颈瓶需用冷水浴冷却,其目的是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NO2和N2O4可以相互转化:2NO2(g)![]() N2O4(g) △H<0。现将一定量NO2和N2O4的混合气体通入体积为2L的恒温密闭容器中,反应物浓度随时间变化关系如图所示。
N2O4(g) △H<0。现将一定量NO2和N2O4的混合气体通入体积为2L的恒温密闭容器中,反应物浓度随时间变化关系如图所示。

(1)图中共有两条曲线X和Y,其中表示NO2浓度随时间变化的曲线是___;a、b、c、d四个点中,表示化学反应处于平衡状态的点是___。
(2)前10min内用NO2表示的化学反应速率v(NO2)=___mol·L-1·min-1。
(3)①据图分析,在25min时采取的措施是___(填序号)。
A.加入催化剂 B.缩小容器体积
C.加入一定量的NO2 D.加入一定量的N2O4
②若在35 min时,保持温度不变,快速缩小容器的体积至1L,气体的颜色变化过程是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com