
【题目】某强酸性无色溶液中可能含下表中的若干种离子。
阳离子 | Mg2+、NH |
阴离子 | SiO |
实验I:取少量该溶液进行如图实验。
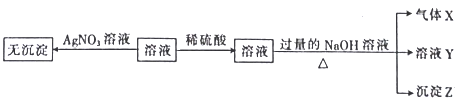
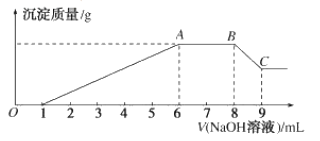
实验II:为了进一步确定该溶液的组成,取200mL原溶液,向该溶液中滴加2molL-1的NaOH溶液,产生沉淀的质量与氢氧化钠溶液体积的关系如图所示。
回答下列问题:
(1)不进行实验就可以推断出,上表中的离子一定不存在的有___种。
(2)通过实验I可以确定该溶液中一定存在的阴离子是___。
(3)写出实验II的图像中BC段对应的离子方程式:___。
(4)A点对应的固体质量为___ g。
(5)该溶液中阴离子的浓度为___ molL-1。
【答案】4 NO![]() Al(OH)3+OH-=[Al(OH)4]-或Al(OH)3+OH-=AlO
Al(OH)3+OH-=[Al(OH)4]-或Al(OH)3+OH-=AlO![]() +2H2O 0.272 0.08
+2H2O 0.272 0.08
【解析】
某强酸性无色溶液中Fe2+、![]() 、
、![]() 、
、![]() 一定不存在;溶液中加入硝酸银不会出现白色沉淀,所以一定不含Cl-;加入硫酸无沉淀产生,一定不含Ba2+,加入过量的氢氧化钠,加热,产生沉淀和气体,则一定存在Mg2+、
一定不存在;溶液中加入硝酸银不会出现白色沉淀,所以一定不含Cl-;加入硫酸无沉淀产生,一定不含Ba2+,加入过量的氢氧化钠,加热,产生沉淀和气体,则一定存在Mg2+、![]() ;为了进一步确定该溶液的组成,取200mL原溶液,向该溶液中滴加2molL-1的NaOH溶液,根据产生沉淀的质量与氢氧化钠溶液体积的关系,得到溶液中一定含有Al3+;根据存在的离子以及量的情况,结合电荷守恒确定其余离子是否存在。
;为了进一步确定该溶液的组成,取200mL原溶液,向该溶液中滴加2molL-1的NaOH溶液,根据产生沉淀的质量与氢氧化钠溶液体积的关系,得到溶液中一定含有Al3+;根据存在的离子以及量的情况,结合电荷守恒确定其余离子是否存在。
(1)某强酸性无色溶液中Fe2+、![]() 、
、![]() 、
、![]() 一定不存在,即不进行实验就可推断共有4种离子一定不存在;
一定不存在,即不进行实验就可推断共有4种离子一定不存在;
(2)强酸性无色溶液中Fe2+、![]() 、
、![]() 、
、![]() 一定不存在;溶液加入硝酸银不会出现白色沉淀,所以一定不含Cl-;加入硫酸无沉淀产生,一定不含Ba2+;加入过量的氢氧化钠,加热,产生沉淀和气体,则一定存在Mg2+、
一定不存在;溶液加入硝酸银不会出现白色沉淀,所以一定不含Cl-;加入硫酸无沉淀产生,一定不含Ba2+;加入过量的氢氧化钠,加热,产生沉淀和气体,则一定存在Mg2+、![]() ;根据电荷守恒,通过实验I可以确定该溶液中一定存在的阴离子是
;根据电荷守恒,通过实验I可以确定该溶液中一定存在的阴离子是![]() ;
;
(3)实验Ⅱ的图像中BC段是氢氧化铝溶于氢氧化钠的过程,对应的离子方程式为Al(OH)3+OH-=![]() +2H2O;
+2H2O;
(4)BC段对应的离子方程式Al(OH)3+OH-=![]() +2H2O,消耗的氢氧化钠是2mol/L×0.001L=0.002mol,所以原溶液中含有铝离子是0.002mol,沉淀镁离子和铝离子一共消耗氢氧化钠2mol/L×0.005L=0.01mol,沉淀Mg2+消耗NaOH物质的量为0.01mol-0.002mol×3=0.004mol,镁离子物质的量为0.002mol,A点得到的固体是0.002mol氢氧化镁和0.002mol氢氧化铝,质量是0.002mol×58g/mol+0.002mol×78g/mol=0.272g,
+2H2O,消耗的氢氧化钠是2mol/L×0.001L=0.002mol,所以原溶液中含有铝离子是0.002mol,沉淀镁离子和铝离子一共消耗氢氧化钠2mol/L×0.005L=0.01mol,沉淀Mg2+消耗NaOH物质的量为0.01mol-0.002mol×3=0.004mol,镁离子物质的量为0.002mol,A点得到的固体是0.002mol氢氧化镁和0.002mol氢氧化铝,质量是0.002mol×58g/mol+0.002mol×78g/mol=0.272g,
(5)该溶液中存在的阴离子是![]() ,根据图像,溶液存在氢离子是0.002mol,存在铵根离子是0.004mol,铝离子、镁离子各是0.002mol,根据电荷守恒,硝酸根离子物质的量n(
,根据图像,溶液存在氢离子是0.002mol,存在铵根离子是0.004mol,铝离子、镁离子各是0.002mol,根据电荷守恒,硝酸根离子物质的量n(![]() )=0.002mol+0.004mol+0.004mol+0.006mol=0.016mol,浓度是c(
)=0.002mol+0.004mol+0.004mol+0.006mol=0.016mol,浓度是c(![]() )=
)=![]() =0.08mol/L。
=0.08mol/L。


科目:高中化学 来源: 题型:
【题目】在两份相同的H2SO4溶液中,分别滴入物质的量浓度相等的Ba(OH)2、NaOH溶液,其导电能力随滴入溶液体积变化的曲线如下图所示,下列分析不正确的是

A. ①代表滴加Ba(OH)2溶液的变化曲线 B. a、c两点,溶液中均大量存在H+和SO42-
C. b、d两点对应的溶液均显中性 D. e点,两溶液中含有相同量的OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应L(s)+aG(g)=bR(g)达到平衡时温度和压强对该反应的影响如下图所示,x轴表示温度,y轴表示平衡混合气中G的体积分数,压强P1>P2,下列判断正确的是
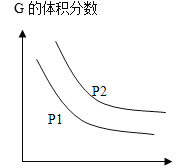
A.a>b
B.△H<0
C.当av正(G)=bv逆(R)可说明反应达到平衡状态
D.增加L的物质的量,可提高G的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题
(1)煤的气化的主要化学反应方程式为________________
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为____________
(3)利用水煤气合成二甲醚的三步反应如下
①2H2(g)+CO(g)=CH3OH(g) △H=-90.8kJ.mo-1
②2CH3OH(g)= CH3OCH3(g)+ H2O(g) △H=-235kJ.mo-1
③CO(g)+H2O(g)=O2(g)+H2(g) △H=-413kJ.mo-1
总反应:3H2(g)+3CO(g)= CH3OCH3(g)+CO2(g)的△H=___________
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是____(填字母代号)![]()
a. 高温高压 b.加入催化剂 c.减少CO2的浓度 d.增加Co的浓度 e.分离出二甲醚
(4)已知反应②2CH3OH(g)= CH3OCH3(g)+ H2O(g)某温度下的平衡常数为400.此温度下,在2L密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
物质的量(mol) | 0.88 | 1.2 | 1.2 |
①加入的CH3OH的起始浓度为_________
②比较此时正、逆反应速率的大小:v正________v逆(填少”、“<”或“=”)
③若加入CH3OH后,经10min反应达到平衡,此时CH3OH的转化率a(CH3OH)=_________c(CH3OCH3)=____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关从海带中提取碘的实验原理和装置能达到实验目的的是

A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I的Cl2
D. 用装置丁吸收氧化浸泡液中I后的Cl2尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的叙述一定不正确的是
A. 向FeCl2溶液中滴加NH4SCN溶液,溶液显红色
B. KAl(SO4) 2·12H2O溶于水可形成 Al(OH)3胶体
C. NH4Cl与Ca(OH)2混合加热可生成NH3
D. Cu与FeCl3溶液反应可生成CuCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】120℃时,1molCO2和3molH2通入1L的密闭容器中反应生成CH3OH和水。测得CO2和CH3OH的浓度随时间的变化如图所示。下列有关说法中不正确的是

A.0~3min内,H2的平均反应速率为0.5mol·L-1·min-1
B.该反应的化学方程式:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)
C.容器内气体的压强不再变化时,反应到达平衡
D.10min后,反应体系达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论正确的是
A. 是Ba(OH)2溶液中滴加NaHSO4溶液之后,溶液的导电能力随滴入NaHSO4溶液体积变化的曲线,说明a点对应的溶液呈碱性
是Ba(OH)2溶液中滴加NaHSO4溶液之后,溶液的导电能力随滴入NaHSO4溶液体积变化的曲线,说明a点对应的溶液呈碱性
B. 表示某放热反应分别在有、无催化剂的情况下,反应过程中的能量变化
表示某放热反应分别在有、无催化剂的情况下,反应过程中的能量变化
C. 是I2+I-I3-中I3-的平衡浓度随温度变化的曲线,说明平衡常数K(T1)<K(T2)
是I2+I-I3-中I3-的平衡浓度随温度变化的曲线,说明平衡常数K(T1)<K(T2)
D. 是室温下用0.1 mol·L-1 NaOH溶液滴定0.1 mol·L-1某酸HX的滴定曲线,说明可用甲基橙判断该反应的终点
是室温下用0.1 mol·L-1 NaOH溶液滴定0.1 mol·L-1某酸HX的滴定曲线,说明可用甲基橙判断该反应的终点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气对环境造成了严重影响,部分城市开展PM2.5和臭氧的监测。下列有关说法正确的是( )
A.臭氧的摩尔质量是48 g
B.同温同压条件下,等质量的氧气和臭氧体积比为2∶3
C.16 g臭氧中含有6.02×1023个原子
D.1.00 mol臭氧中含有电子总数为18×6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com