
| A、1 mol氢的质量为2g |
| B、OH-的摩尔质量为17g |
| C、标准状况下,水的摩尔体积是22.4 L?mol-1 |
| D、1mol Ne 含有的电子数目为6.02×1024 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原电池是将电能转变为化学能的装置 |
| B、等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
| C、电解硫酸钠溶液,在阴极和阳极析出产物的物质的量之比为1:2 |
| D、化石燃料和植物燃料燃烧时放出的能量均来源于太阳能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、因为氮易液化,液氮在气化时会吸收大量的热量,所以液氮可作制冷剂 |
| B、盐卤点豆腐,明矾净水与胶体的性质有关 |
| C、H2O2、SO2、O3等都用于织物漂白,它们的漂白原理相同 |
| D、硫酸和硝酸都是重要的工业原料,工业上可用于制化肥、农药和炸药 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
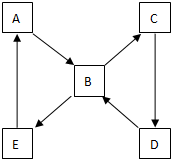 如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).单质A能与某气态单质化合生成化合物B.
如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).单质A能与某气态单质化合生成化合物B.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com