
��ԭ�������Ǵ�������(��Cr2O72����CrO42��)��ҵ��ˮ�ij��÷������������£�
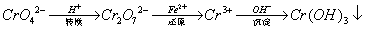
��֪ת�������з�ӦΪ��2CrO42��(aq)+2H+(aq)  Cr2O72��(aq)+H2O(1)��ת����������Һ�и�Ԫ�غ���Ϊ28.6g/L��CrO42����10/11ת��ΪCr2O72��������˵������ȷ����
Cr2O72��(aq)+H2O(1)��ת����������Һ�и�Ԫ�غ���Ϊ28.6g/L��CrO42����10/11ת��ΪCr2O72��������˵������ȷ����
A�������̷�(FeSO4��7H2O)(M=278)����ԭ��������1L��ˮ��������Ҫ917.4g
B����Һ��ɫ���ֲ��䣬˵���������淴Ӧ�ﵽ��ƽ��״̬
C��������ת����Ӧ��ƽ�ⳣ��K=1��1014����ת����������Һ��pH=6
D��������Ksp[Cr(OH)3]=1��10��32��Ҫʹ�������ˮ��c(Cr3+)����1��10��5mol/L��Ӧ����Һ��pH=5
��֪ʶ�㡿���ܵ���ʵ��ܽ�ƽ�⼰����ת���ı���
���𰸽�����A ������ת����������Һ�и�Ԫ�غ���Ϊ28.6g/L����1L��ˮ��n��Cr��=28.6g��52g/mol=0.55mol��
A�������̷���FeSO4•7H2O����M=278������ԭ��������1L��ˮ������ҪxmolFeSO4•7H2O����������ԭ��Ӧ���������ͻ�ԭ����ʧ������Ŀ��ȿ�֪0.55����6-3��=x����3-2����x=1.65��m��FeSO4•7H2O��=1.65mol��278g/mol=458.7g����A����
B������ƽ�⣺2Cr O42-����ɫ��+2H+⇌Cr2O42-����ɫ��+H2O������ɫ���䣬˵��Ũ�Ȳ��䣬��ﵽƽ��״̬����B��ȷ��
C��1L��ˮ��n��Cr��==0.55mol��CrO42-��10/11ת��ΪCr2O72-�����ữ��c��CrO42-��=0.55mol/L����1-10/11��=0.05mol/L��c��Cr2O72-��=0.55mol/L��10/11��1/2=0.25mol/L��������ת����Ӧ��ƽ�ⳣ��K=1��1014����c(Cr 2O72−)/ c2(CrO42−)c2(H+)=1��1014��c��H+��=1��10-6mol/L������pH=6����C��ȷ��
D��������Ksp[Cr��OH��3]=1��10-32��Ҫʹ�������ˮ��c��Cr3+������1��10-5mol/L����c��Cr3+����c3��OH-��=1��10-32��c��OH-��=1��10-9mol/L��pH=5����D��ȷ��
�ʴ�ѡA
��˼·�㲦�����⿼�����ܵ���ʵ��ܽ�ƽ�⣬Ϊ��Ƶ���㣬������ѧ���ķ��������ͼ���
�����Ŀ��飬ע�������ؼ��㹫ʽ�����ã��Ѷ��еȡ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���з���˵����ȷ���ǣ�
A���������ڼ�
B���������ڷ�����
C�����ȷ�Ӧ����������ԭ��Ӧ
D�������ܷ���������Ӧ������ȩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ࡢ֬���͵�������ά����������������������Ӫ�����ʡ�����������ȷ����
A��ֲ���Ͳ���ʹ������Ȼ�̼��Һ��ɫ
B�����ۺ���ά�ض�������Ϊ��ҵ�����������ǵ�ԭ��
C�����ࡢ��֬����������һ�������¶��ܷ���ˮ�ⷴӦ
D����������Һ������ͭ������ij�������������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����֪t��ʱAgCI��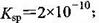 ������t��ʱAg2CrO4
������t��ʱAg2CrO4
��ˮ�еij����ܽ�ƽ��������ͼ��ʾ������˵����ȷ����
A.��t��ʱ��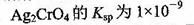
B���ڱ���Ag2CrO4��Һ�м���K2CrO4��ʹ��Һ��Y�㵽
X��
C����t��ʱ����0.01 mol/LAgNO3��Һ�ζ�20 mL 0.01 mol/L
KCI��0.01 mol/L��K2CrO4�Ļ����Һ��CrO42���ȳ���
D����t��ʱ����Ӧ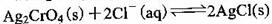
 ��ƽ�ⳣ��
��ƽ�ⳣ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��NAΪ�����ӵ�������ֵ������˵����ȷ����
A�������£�0.05 mol��L��1Fe2(SO4)3��Һ�к�Fe3+��ĿС��0.1 NA
B��30g��ȩ�к����Ӷ���Ϊ4NA
C��12 gʯīϩ������ʯī���к�����Ԫ���ĸ�����0.5NA
D�������£�7.1 g����������ʯ�����ַ�Ӧת�Ƶ�����С��0.1 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
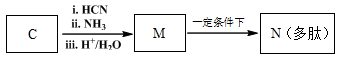
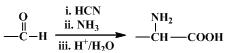
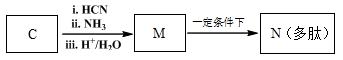
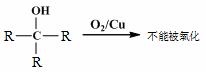
 �߷��ӻ�����G����Ϊ﮵���� Li+ Ǩ�ƵĽ��ʣ��ϳ�G���������£�
�߷��ӻ�����G����Ϊ﮵���� Li+ Ǩ�ƵĽ��ʣ��ϳ�G���������£�
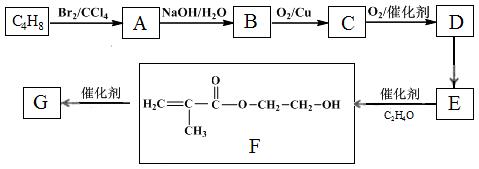
��֪����
��
��1��D������������ ��
��2��A��B�ķ�Ӧ������ ��
��3��C�Ľṹ��ʽ�� ��
��4��D��E��Ӧ������ ��
��5��G�Ľṹ��ʽ�� ��
��6����֪��
M��N�Ļ�ѧ����ʽ�� ��
��7��D��ͬ���칹���У�д����˳���칹�Ľṹ��ʽ
ע�⣺�������ǻ�����ͬһ��̼�ϣ��ǻ�����˫����̼�ϵĽṹ���ȶ������迼�ǡ�
�ڲ����ǹ������ͻ�״�ṹ ��˳���ṹ��д��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij�εĻ�����к���0.2 mol Na+��0.4 mol Mg2+��0.1 mol Cl�� �� SO42�������京SO42�������ʵ���Ϊ�� ��
A��0.1mol B��0.3mol C��0.5mol D��0.45mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵��������� �� ��
A��6.02��1023�ǰ����ӵ������Ľ���ֵ
B�������ӵ³������������ʵ�����1mol
C��1mol 12Cԭ�ӵ�����Ϊ12g
D�������Ħ��������98��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪3.6 g̼��6.4 g������ȼ�գ�����Ӧ��ľ�����÷ų�����a kJ����֪12.0 g̼��ȫȼ�գ��ų�����Ϊ b kJ�����Ȼ�ѧ����ʽC(s)��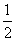 O2(g)===CO(g)����H��Q��Q���ڣ� ��
O2(g)===CO(g)����H��Q��Q���ڣ� ��
A����(a��b) kJ��mol��1 B����(a��b) kJ��mol��1
C����(5a��0.5b) kJ��mol��1 D����(10a��b) kJ��mol��1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com